题目内容
短周期元素A、B、C、D、E在元素周期表中的位置如图所示,B是形成化合物种类最多的元素.
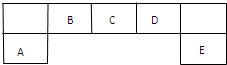
请回答下列问题:
(1)描述D在元素周期表中的位置: .
(2)比较A、C、D元素简单离子半径的大小: > > (填微粒符号).
(3)E的氢化物与其最高价氧化物的水化物的钾盐共热能发生反应,生成一种气体单质,反应的化学反应方程式为 .
(4)F与D同主族且相邻,请说出D的氢化物比F的氢化物稳定的根本原因: ;用高能射线照射液态水时,一个水分子能释放出一个电子,同时产生一种具有较强的氧化性的阳离子,试写出阳离子的电子式: ,写出该阳离子与F氢化物的水溶液反应的离子方程式: .
(5)在Fe和Cu 的混合物中加入一定量的C的最高价氧化物的水化物稀溶液,充分反应后剩余金属m1 g,再向其中加入一定量的稀硫酸,充分反应后,剩余金属m2 g.下列说法正确的是 .
A.加入稀硫酸前,加入稀硫酸后的溶液中肯定都有Cu2+
B.加入稀硫酸前,加入稀硫酸后的溶液中肯定都有Fe2+
C.m1一定大于m2
D.剩余固体m1g中一定有单质铜,剩余固体m2g中一定没有单质铜.

请回答下列问题:
(1)描述D在元素周期表中的位置:
(2)比较A、C、D元素简单离子半径的大小:
(3)E的氢化物与其最高价氧化物的水化物的钾盐共热能发生反应,生成一种气体单质,反应的化学反应方程式为
(4)F与D同主族且相邻,请说出D的氢化物比F的氢化物稳定的根本原因:
(5)在Fe和Cu 的混合物中加入一定量的C的最高价氧化物的水化物稀溶液,充分反应后剩余金属m1 g,再向其中加入一定量的稀硫酸,充分反应后,剩余金属m2 g.下列说法正确的是
A.加入稀硫酸前,加入稀硫酸后的溶液中肯定都有Cu2+
B.加入稀硫酸前,加入稀硫酸后的溶液中肯定都有Fe2+
C.m1一定大于m2
D.剩余固体m1g中一定有单质铜,剩余固体m2g中一定没有单质铜.
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:B是形成化合物种类最多的元素,则B为碳,根据短周期元素在元素周期表位置可知:A为Al、C为N、D为O、E为Cl.
(1)主族元素周期数=电子层数、主族族序数=最外层电子数;
(2)电子层结构相同,核电荷数越大离子半径越小;
(3)HCl与KClO4共热能发生反应,生成一种气体单质为氯气,反应同时生成KCl与水;
(4)D为O,F与D同主族且相邻说明F为S,元素非金属性越强气态氢化物的稳定性越强;
用高能射线照射液态水时,一个水分子能释放出一个电子,同时产生一种具有较强的氧化性的阳离子,失去一个电子后得到的阳离子含有9个电子为H2O+,该阳离子中O与H之间形成1对共用电子对;
H2O+与H2S发生氧化还原反应生成S、水与H+;
(5)稀硝酸先氧化铁后再与铜反应,剩余固体m1 g和m2g中一定有单质铜,再加入稀硫酸,因硝酸根在酸性条件下具有强氧化性,故剩余金属无论是铁还是铜还是铁铜混合物,都会溶解.
(1)主族元素周期数=电子层数、主族族序数=最外层电子数;
(2)电子层结构相同,核电荷数越大离子半径越小;
(3)HCl与KClO4共热能发生反应,生成一种气体单质为氯气,反应同时生成KCl与水;
(4)D为O,F与D同主族且相邻说明F为S,元素非金属性越强气态氢化物的稳定性越强;
用高能射线照射液态水时,一个水分子能释放出一个电子,同时产生一种具有较强的氧化性的阳离子,失去一个电子后得到的阳离子含有9个电子为H2O+,该阳离子中O与H之间形成1对共用电子对;
H2O+与H2S发生氧化还原反应生成S、水与H+;
(5)稀硝酸先氧化铁后再与铜反应,剩余固体m1 g和m2g中一定有单质铜,再加入稀硫酸,因硝酸根在酸性条件下具有强氧化性,故剩余金属无论是铁还是铜还是铁铜混合物,都会溶解.
解答:
解:B是形成化合物种类最多的元素,则B为碳,根据短周期元素在元素周期表位置可知:A为Al、C为N、D为O、E为Cl.
(1)D为O元素,原子核外有2个电子层、最外层电子数为6,位于第二周期第ⅥA族,
故答案为:第二周期第ⅥA族;
(2)Al3+、O2-、N3-电子层结构相同,核电荷数越大离子半径越小,故离子半径:N3->O2->Al3+,
故答案为:N3->O2->Al3+;
(3)HCl与KClO4共热能发生反应,生成一种气体单质为氯气,反应同时生成KCl与水,该反应化学方程式为:8HCl+KClO4
KCl+4Cl2↑+4H2O,
故答案为:8HCl+KClO4
KCl+4Cl2↑+4H2O;
(4)D为O,F与D同主族且相邻说明F为S,由于元素非金属性:O>S,所以气态氢化物的稳定性:H2O>H2S;
用高能射线照射液态水时,一个水分子能释放出一个电子,同时产生一种具有较强的氧化性的阳离子,失去一个电子后得到的阳离子含有9个电子为H2O+,该阳离子中O与H之间形成1对共用电子对,其电子式为: ;H2O+与H2S发生氧化还原反应生成S、水与H+,反应离子方程式为:2H2O++H2S=S↓+2H2O+2H+,
;H2O+与H2S发生氧化还原反应生成S、水与H+,反应离子方程式为:2H2O++H2S=S↓+2H2O+2H+,
故答案为:氧的非金属性比硫强; ;2H2O++H2S=S↓+2H2O+2H+;
;2H2O++H2S=S↓+2H2O+2H+;
(5)A.稀硝酸先氧化铁后再与铜反应,若加入稀硫酸前和加入稀硫酸后氧化的只有铁,那么溶液中无Cu2+,故A错误;
B.因为铁的还原性大于铜,稀硝酸先氧化铁后再与铜反应,剩余的金属中一定含有Cu,因此溶液中必含有Fe2+,故B正确;
C.再加入稀硫酸,因硝酸根在酸性条件下具有强氧化性,故剩余金属无论是铁还是铜还是铁铜混合物,都会溶解,则m1一定大于m2,故C正确;
D.稀硝酸先氧化铁后再与铜反应,剩余固体m1 g和m2g中都一定有单质铜,故D错误.
故答案为:BC.
(1)D为O元素,原子核外有2个电子层、最外层电子数为6,位于第二周期第ⅥA族,
故答案为:第二周期第ⅥA族;
(2)Al3+、O2-、N3-电子层结构相同,核电荷数越大离子半径越小,故离子半径:N3->O2->Al3+,
故答案为:N3->O2->Al3+;
(3)HCl与KClO4共热能发生反应,生成一种气体单质为氯气,反应同时生成KCl与水,该反应化学方程式为:8HCl+KClO4
| ||
故答案为:8HCl+KClO4
| ||
(4)D为O,F与D同主族且相邻说明F为S,由于元素非金属性:O>S,所以气态氢化物的稳定性:H2O>H2S;
用高能射线照射液态水时,一个水分子能释放出一个电子,同时产生一种具有较强的氧化性的阳离子,失去一个电子后得到的阳离子含有9个电子为H2O+,该阳离子中O与H之间形成1对共用电子对,其电子式为:
 ;H2O+与H2S发生氧化还原反应生成S、水与H+,反应离子方程式为:2H2O++H2S=S↓+2H2O+2H+,
;H2O+与H2S发生氧化还原反应生成S、水与H+,反应离子方程式为:2H2O++H2S=S↓+2H2O+2H+,故答案为:氧的非金属性比硫强;
 ;2H2O++H2S=S↓+2H2O+2H+;
;2H2O++H2S=S↓+2H2O+2H+;(5)A.稀硝酸先氧化铁后再与铜反应,若加入稀硫酸前和加入稀硫酸后氧化的只有铁,那么溶液中无Cu2+,故A错误;
B.因为铁的还原性大于铜,稀硝酸先氧化铁后再与铜反应,剩余的金属中一定含有Cu,因此溶液中必含有Fe2+,故B正确;
C.再加入稀硫酸,因硝酸根在酸性条件下具有强氧化性,故剩余金属无论是铁还是铜还是铁铜混合物,都会溶解,则m1一定大于m2,故C正确;
D.稀硝酸先氧化铁后再与铜反应,剩余固体m1 g和m2g中都一定有单质铜,故D错误.
故答案为:BC.
点评:本题考查了元素周期表和元素周期律的综合应用,涉及微粒变价比较、化学方程式书写、电子式、硝酸性质等,难度中等,(5)中注意再加入稀硫酸,硝酸根在酸性条件下具有强氧化性.

练习册系列答案
 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案
相关题目
几种短周期元素的原子半径及主要化合价如表( )
下列叙述错误的是(其中NA表示阿伏加德罗常数的值)
| 元素代号 | X | Y | Z | M | N | P |
| 原子半径/nm | 0.186 | 0.143 | 0.075 | 0.074 | 0.152 | 0.099 |
| 元素的主要化合价 | +1 | +3 | +5、-3 | -2 | +1 | +7、-1 |
| A、X、N元素的金属性:X>N |
| B、Y、M元素形成的离子化合物是工业冶炼Y的原料 |
| C、X单质在M单质中燃烧生成的化合物39g中共含有0.5NA个阴离子 |
| D、标准状况下1L 1mol?L-1的YP3溶液中含有NA个Y3+离子 |
2013年世界环境日中国主题为“同呼吸,共奋斗”.河南各地广泛开展了一系列活动.下列活动不符合这一主题的是( )
| A、推进以防治PM2.5为重点的大气污染防治工作 |
| B、积极推广风能、太阳能、氢能等新型能源的使用 |
| C、将生活垃圾、废品分类,实现资源再循环 |
| D、将高能耗、高污染的企业迁至偏僻的农村地区,提高当地居民收入 |
“空对空”响尾蛇导弹头部的“红外眼睛”,能分辩出0.001℃的温差变化,它是由热敏陶瓷材料和热释电陶瓷材料做成的.下列叙述中不正确的是( )
| A、“红外眼睛”对热非常敏 |
| B、“红外眼睛”的热目标是敌机发动机或尾部喷口高温区 |
| C、“红外眼睛”的电阻值随温度明显变化 |
| D、“红外眼睛”的工作原理与人眼相同 |
 右图是一个化学过程的示意图.已知甲池的总反应式为:
右图是一个化学过程的示意图.已知甲池的总反应式为:
 已知甲、乙、丙、丁4种物质均含有常见金属元素A,其中甲为红棕色粉末,它们之间有如图所示的转化关系(转化过程中部分产物未标出)
已知甲、乙、丙、丁4种物质均含有常见金属元素A,其中甲为红棕色粉末,它们之间有如图所示的转化关系(转化过程中部分产物未标出)