题目内容
如图所示,装置在常温下工作(溶液体积变化忽略不计)。闭合K,灯泡发光。下列叙述中不正确的是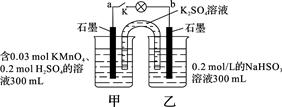
| A.当电路中有1.204×1022个电子转移时,乙烧杯中溶液的pH约为1 |
| B.电池工作时,盐桥中的K+移向甲烧杯,外电路的电子方向是从b到a |
| C.电池工作时,甲烧杯中由水电离出的c(H+)逐渐减小 |
| D.乙池中的氧化产物为SO42- |
C
解析试题分析:A.n(e-)=1.204×1022÷6.02×1023=0.02mol.则在乙烧杯中发生反应的NaHSO3的物质的量为0.01mol。产生的H+的物质的量为0.01mol。c(H+)=0.01mol÷0.1L=0.1mol/L。溶液中的H+主要是由NaHSO3反应产生。所以pH=1正确。B.在该原电池反应中,乙池的石墨电极为负极,甲池的石墨电极为正极。根据同种电荷相互排斥,异种电荷相互吸引的原则,电池工作时,盐桥中的K+移向甲烧杯,外电路的电子方向是从b到a。正确。C.电池工作时,甲烧杯中MnO4-不断得到电子,变为Mn2+,消耗H+,溶液中的c(H+)不断减小,所以由水电离出的c(H+)逐渐增大。错误。D.在乙池中HSO3-不断被氧化,变为SO42-。因此该烧杯的氧化产物为SO42-。
考点:考查原电池的反应原理的知识。

某化学学习小组学习电化学后,设计了下面的实验装置图:
下列有关该装置图的说法中正确的是
| A.合上电键后,盐桥中的阳离子向甲池移动 |
| B.合上电键后,丙池为电镀银的电镀池 |
| C.合上电键后一段时间,丙池中溶液的pH增大 |
| D.合上电键后一段时间,当丙池中生成标准状况下560 mL气体时,丁池中理论上最多产生2.9 g固体 |
银锌蓄电池是一种高能电池,它的两极材料分别为锌和氧化银,电解质溶液为KOH溶液,放电时它的正、负两极的电极反应式如下:
Ag2O+H2O+2e-=2Ag+2OH-,Zn+2OH--2e-=Zn(OH)2。
下列判断正确的是( )
| A.锌为负极,氧化银为正极 |
| B.锌为正极,氧化银为负极 |
| C.原电池工作时,负极区溶液pH增大 |
| D.原电池反应的化学方程式为Zn+Ag2O+H2O=Zn(OH)2+2Ag |
把等物质的量的Na2SO4、NaCl、AgNO3混合物放入足量水中,经充分搅拌后,将
所得溶液用石墨电极进行电解,阳极生成的物质是( )
| A.H2 | B.Ag | C.Cl2 | D.O2 |
关于镀铜和电解精炼铜,下列说法中正确的是( )
| A.都用粗铜作阳极、纯铜作阴极 |
| B.电解液的成分都保持不变 |
C.阳极反应都只有Cu-2e- Cu2+ Cu2+ |
D.阴极反应都只有Cu2++2e- Cu Cu |
用惰性电极进行电解,下列说法正确的是( )
| A.电解稀硫酸,实质上是电解水,故溶液pH不变 |
| B.电解稀氢氧化钠溶液,要消耗OH-,故溶液pH减小 |
| C.电解硫酸钠溶液,在阴极上和阳极上析出产物的物质的量之比为1∶2 |
| D.电解氯化铜溶液,在阴极上和阳极上析出产物的物质的量之比为1∶1 |
如下图所示,将紧紧缠绕不同金属的铁钉放入培养皿中,再加入含有适量酚酞和NaCl的琼脂热溶液,冷却后形成琼胶(离子在琼胶内可以移动),下列叙述正确的是( )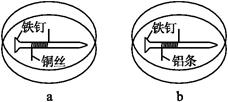
| A.a中铁钉附近呈现红色 | B.b中铁钉上发生还原反应 |
| C.a中铜丝上发生氧化反应 | D.b中铝条附近有气泡产生 |
一种光化学电池的结构如下图,当光照在表面涂有氯化银的银片上时,AgCl(s) Ag(s)+Cl(AgCl),[Cl(AgCl)表示生成的氯原子吸附在氯化银表面],接着Cl(AgCl)+e-―→Cl-(aq),若将光源移除,电池会立即回复至初始状态。下列说法正确的是( )
Ag(s)+Cl(AgCl),[Cl(AgCl)表示生成的氯原子吸附在氯化银表面],接着Cl(AgCl)+e-―→Cl-(aq),若将光源移除,电池会立即回复至初始状态。下列说法正确的是( )
| A.光照时,电流由Y流向X |
| B.光照时,Pt电极发生的反应为2Cl-+2e-=Cl2 |
| C.光照时,Cl-向Ag电极移动 |
D.光照时,电池总反应为AgCl(s)+Cu+(aq) Ag(s)+Cu2+(aq)+Cl- Ag(s)+Cu2+(aq)+Cl- |
 2H2O
2H2O 2H2O
2H2O