题目内容
分别取四种溶液于四支试管中进行实验,结论正确的是
| | 操作 | 现象 | 结论 |
| A | 加入浓NaOH溶液,加热 | 湿润的红色石蕊试纸变蓝 | 原溶液中一定含有NH4+ |
| B | 加入稀盐酸,将产生的气体通入澄清石灰水中 | 溶液变浑浊 | 原溶液中一定含有CO32- |
| C | 加入少量双氧水,再加几滴KSCN溶液 | 溶液变红 | 原溶液中一定含有Fe2+ |
| D | 加入BaCl2溶液,再加入稀硝酸 | 有白色沉淀生成 | 原溶液中一定含有SO42- |
A
解析试题分析:A、检验溶液中有是否含有NH4+,向溶液中加入NaOH溶液并加热,发生离子反应: NH4++OH-=NH3↑+H2O,产生NH3,能使湿润的红色石蕊试纸变蓝,正确;B、向某溶液中加入稀盐酸,产生能使澄清石灰水变浑浊的无色气体,气体可能为二氧化硫或二氧化碳,则溶液中可能存在HCO3-、SO32-、HSO3-、CO32-,错误;C、向某溶液中先加入少量双氧水,再加几滴KSCN溶液,溶液变为红色,该溶液中可能含有Fe2+或Fe3+,或二者都有,若检验亚铁离子,应先加几滴KSCN溶液,不变色,再加双氧水,错误;D、向该溶液滴加BaCl2溶液,当不加稀硝酸时,沉淀可能是由于Ba2+造成的BaCO3或者是BaSO4,也可能是由于Cl-生成的AgCl沉淀.由于后来又滴加了稀硝酸,沉淀不溶解,所以该沉淀可能是BaSO4或者是AgCl。所以对该实验下一定含有硫酸根离子的结论是不正确的.如果想排除类似干扰,可以用Ba(NO3)2代替BaCl2,上面的结论就是合理的.检验溶液中有SO42-,应先加入盐酸,如无现象,再加入氯化钡和稀硝酸,如生成沉淀,说明含有SO42-,以排除Cl-的干扰,错误。
考点:考查化学实验方案的评价、离子的检验。

 阅读快车系列答案
阅读快车系列答案下列装置、操作及说法正确的是( )
| A.图1用于海水蒸馏 | B.图2用于铜与浓硝酸反应制取NO2 |
| C.图3用于实验室制氨 | D.图4中X若为四氯化碳,可用于吸收氯化氢气体,并防止倒吸 |
欲除去下列物质中混入的少量杂质(括号内物质为杂质),错误的是
| A.乙酸乙酯(乙酸):加饱和Na2CO3溶液,充分振荡静置后,分液 |
| B.乙醇(水):加入新制生石灰,蒸馏 |
| C.溴苯(溴):加入NaOH溶液,充分振荡静置后,分液 |
| D.乙酸(乙醇):加入金属钠,蒸馏 |
现有三组溶液:①汽油和氯化钠溶液 ②39%的乙醇溶液 ③氯化钠和单质溴的水溶液,分离以上各混合液的正确方法依次是( )。
| A.分液、萃取、蒸馏 | B.萃取、蒸馏、分液 |
| C.分液、蒸馏、萃取 | D.蒸馏、萃取、分液 |
下图是某工厂对海水资源综合利用的示意图,下列说法错误的是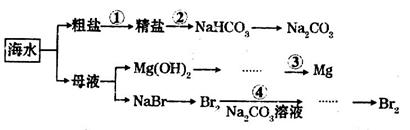
A.第①步中除去粗盐中的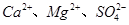 ,依次加入的物质可以是 ,依次加入的物质可以是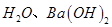 溶液、 溶液、 溶液和盐酸 溶液和盐酸 |
B.第②步发生的化学反应为: |
| C.第③步工业上电解熔融的Mg(OH)2冶炼金属Mg |
| D.第④步用Na2CO3溶液吸收Br2过程中,既有溴元素被氧化也有溴元素被还原 |
下列说法正确的是( )
| A.可用加热的方法除去混在碳酸钠固体中的碳酸氢钠固体 |
| B.除去CO中少量的O2,可将混合气体通过灼热的Cu网 |
| C.向某溶液中加入盐酸,产生使澄清石灰水变浑浊的气体,该溶液中一定含有CO32- |
| D.向某溶液中加入盐酸酸化的BaCl2溶液有白色沉淀,该溶液中一定含有SO42- |
海洋中资源丰富,如下图所示,下列有关说法正确的是
| A.工段③④⑤是溴元素的富集过程,③④⑤中均发生了氧化还原反应 |
| B.工段②中结晶出的MgCl2·6H2O可在空气中受热分解制无水MgCl2 |
| C.氯碱工业通过电解NaCl溶液,主要生产Cl2、H2和纯碱 |
| D.工段①中除去粗盐中的SO42-、Ca2+、Mg2+、Fe3+等杂质,操作顺序为:加入足量BaCl2溶液→加入足量NaOH溶液→加入足量Na2CO3溶液→加入足量盐酸→过滤 |
现有四组分散系:①汽油和水形成的乳浊液;②含有泥沙的食盐水;③溶有碘(I2)的碘化钾溶液;④乙二醇和丙三醇混合溶液(乙二醇和丙三醇的部分物理性质见下表)。
| 物质 | 熔点/℃ | 沸点/℃ | 密度/g·cm-3 | 溶解性 |
| 乙二醇 | -11.5 | 198 | 1.11 | 易溶于水和乙醇 |
| 丙三醇 | 17.9 | 290 | 1.26 | 能跟水、酒精以任意比互溶 |
请用下图所示的仪器分离以上各混合液,仪器和方法不能对应的是
⑴
 ⑵
⑵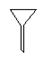 ⑶
⑶ ⑷
⑷
A.①-⑶-分液 B.②-⑵-过滤
C.③-⑵-萃取 D.④-⑴-蒸馏
除去粗盐中的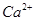 、
、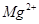 、
、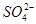 ,可先将粗盐溶于水,然后进行下列五项操作:①过滤;②加过量的氢氧化钠溶液;③加适量的盐酸;④加过量的碳酸钠溶液;⑤加过量的氯化钡溶液。下列操作顺序正确的是
,可先将粗盐溶于水,然后进行下列五项操作:①过滤;②加过量的氢氧化钠溶液;③加适量的盐酸;④加过量的碳酸钠溶液;⑤加过量的氯化钡溶液。下列操作顺序正确的是
| A.②⑤④①③ | B.⑤②①④③ |
| C.①④②⑤③ | D.④①②⑤③ |