��Ŀ����
����Ŀ���������д����ı�����Դ�������ǹ�ҵ�����ú�ˮ��ȡ���þ������ͼ��
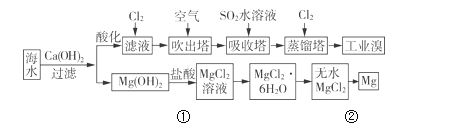
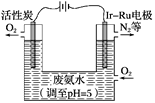
��1����ȡ��Ĺ����У��ڵ�2��Br����Br2 ��ת����ÿ����1mol�����ı��������______L��
��2�����������У��������Ͽ�����������Ҳ������Br2����________��
A��KBr B��Na2SO4 C��FeCl3 D��H2S
��3�����������з�����Ӧ�����ӷ���ʽ��_____________________��
��4��д��������þ�õ�þ���������漰���ķ�Ӧ����ʽ��_____________ ��____________��
���𰸡�22.4 D SO2+Br2+2H2O=4H++2Br-+SO42- Mg��OH��2+2HCl=MgCl2+2H2O MgCl2(����) ![]() Mg+Cl2��
Mg+Cl2��
��������
��1����ȡ��Ĺ����У��ڵ�2��Br����Br2 ��ת���з����ķ�Ӧ��2Br-+ Cl2= Br2+2 Cl����
��2�����������嵥�ʱ���ԭΪ�����ӣ�
��3�����������������������Ӧ��������������������Ӧ�����ӷ���ʽ��
��4���������������þ�����ᷴӦ�����Ȼ�þ��ˮ��������ǵ�������Ȼ�þ����þ��������
��1����ȡ��Ĺ����У��ڵ�2��Br����Br2 ��ת���з����ķ�Ӧ��2Br-+ Cl2= Br2+2 Cl�������ݷ���ʽ��ÿ����1mol������1mol��������״���µ������22.4L��
��2��A��KBr������Br2��Ӧ���ʲ�ѡA��
B��Na2SO4��ԭ�ԣ�������Br2��Ӧ���ʲ�ѡB��
C��FeCl3������Br2��Ӧ ���ʲ�ѡC��
D��H2S��Br2��Ӧ��������������ʣ���ѡD��
��3�����������������������Ӧ��������������ᣬ������Ӧ�����ӷ���ʽ��SO2+Br2+2H2O=4H++2Br-+SO42����
��4���������������þ�����ᷴӦ�����Ȼ�þ��ˮ����Ӧ����ʽ��Mg��OH��2+2HCl=MgCl2+2H2O��������ǵ�������Ȼ�þ����þ����������Ӧ����ʽ��MgCl2(����) ![]() Mg+Cl2����
Mg+Cl2����

 ���㼤�������100�ִ��Ծ�ϵ�д�
���㼤�������100�ִ��Ծ�ϵ�д�