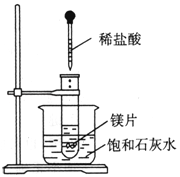
题目内容
【题目】一种“人工固氮”的新方法是在常温、常压、光照条件下,N2在催化剂表面与水发生反应生成NH3:N2+3H2O2NH3+ ![]() O2进一步研究NH3生成量与温度的关系,部分实验数据见表(反应时间3h):
O2进一步研究NH3生成量与温度的关系,部分实验数据见表(反应时间3h):
T/℃ | 30 | 40 | 50 |
生成NH3量/(10﹣6 mol) | 4.8 | 5.9 | 6.0 |
请回答下列问题:
(1)50℃时从开始到3h内以O2物质的量变化表示的平均反应速率为molh﹣1 .
(2)该反应过程与能量关系可用如图表示,则反应的热化学方程式是: . 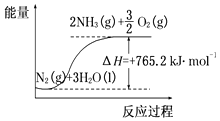
【答案】
(1)1.5×10﹣6
(2)N2(g)+3H2O(l)=2NH3(g)+ ![]() O2(g)△H=+765.2kJ?mol﹣1
O2(g)△H=+765.2kJ?mol﹣1
【解析】解:(1)50℃时从开始到3h内生成氨气为6×10﹣6mol,则生成氧气为4.5×10﹣6mol,以O2物质的量变化表示的平均反应速率为 ![]() molh﹣1=1.5×10﹣6molh﹣1 , 所以答案是:1.5×10﹣6;(2)由图可知反应物、生成物及能量变化,反应的热化学方程式是N2(g)+3H2O(l)=2NH3(g)+
molh﹣1=1.5×10﹣6molh﹣1 , 所以答案是:1.5×10﹣6;(2)由图可知反应物、生成物及能量变化,反应的热化学方程式是N2(g)+3H2O(l)=2NH3(g)+ ![]() O2(g)△H=+765.2kJmol﹣1 ,
O2(g)△H=+765.2kJmol﹣1 ,
所以答案是:N2(g)+3H2O(l)=2NH3(g)+ ![]() O2(g)△H=+765.2kJmol﹣1 .
O2(g)△H=+765.2kJmol﹣1 .
【考点精析】解答此题的关键在于理解反应速率的定量表示方法的相关知识,掌握反应速率的单位:mol/(L·min)或mol/(L·s) v=△c-△t.

【题目】有一无色透明溶液,欲确定是否含有下列离子:K+、Mg2+、Al3+、Fe2+、Ba2+、NO3﹣、SO42﹣、Cl﹣、I﹣、HCO3﹣ , 取该溶液的实验如下:
实验步骤 | 实验现象 |
(1)取少量该溶液,加几滴甲基橙 | 溶液变红色 |
(2)取少量该溶液加热浓缩,加Cu片和浓硫酸,加热 | 有无色气体产生,气体遇空气可以变成红棕色 |
(3)取少量该溶液,加BaCl2溶液 | 有白色沉淀生成 |
(4)取(3)中的上层清液,加AgNO3溶液 | 有稳定的白色沉淀生成,且不溶于稀硝酸 |
(5)取少量该溶液,加入NaOH溶液 | 有白色沉淀生成,当NaOH过量时,沉淀部分溶解 |
由此判断,下列说法正确的是( )
A.根据实验(1)可以确定溶液中不含有HCO![]() 和I﹣ , 因为这二个离子相对应的酸为弱酸
和I﹣ , 因为这二个离子相对应的酸为弱酸
B.溶液中一定存在的离子是NO![]() 、SO
、SO![]() 、Cl﹣、Mg2+、Al3+;溶液中肯定不存在的离子是:Fe2+、HCO
、Cl﹣、Mg2+、Al3+;溶液中肯定不存在的离子是:Fe2+、HCO![]() 、I﹣、Ba2+
、I﹣、Ba2+
C.为进一步确定其它离子,应该补充焰色反应的实验来检验K+就可以
D.通过实验(1)和(2)就可以确定溶液中一定含有NO![]() ,一定不含有Fe2+、I﹣、HCO
,一定不含有Fe2+、I﹣、HCO![]() ,所以实验步骤(4)的设计是错误的
,所以实验步骤(4)的设计是错误的