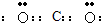题目内容
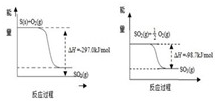
热化学方程式S(g)+O2(g)A.S(g)+O2(g)![]() SO2(l) |ΔH|>297.3 kJ·mol-1
SO2(l) |ΔH|>297.3 kJ·mol-1
B.S(g)+O2(g)![]() SO2(l) |ΔH|<297.3 kJ·mol-1
SO2(l) |ΔH|<297.3 kJ·mol-1
C.1 mol SO2的键能总和小于1 mol S和1 mol O2的键能总和
D.1 mol SO2的键能总和大于1 mol S和1 mol O2的键能总和
解析:对同一物质而言,状态不同,本身含有的化学能不同,它们的能量大小关系为E(g)>E(l)>E(s),解题时可以用画图的方法。
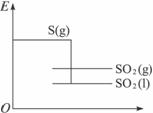
由右图可以看出生成SO2(l)时放出的热量大于297.3 kJ,所以A项正确;B项不正确;注意键能与分子内能的关系,键能越大,分子贮存的能量越少,越稳定,因该反应为放热反应,故SO2分子中贮存的能量低于反应物分子中贮存的能量,SO2中键能总和大于S和O2的键能总和,所以C项不正确;D项正确。
答案:AD

练习册系列答案
 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案
相关题目
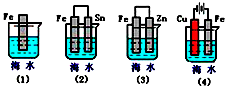 写出下列反应的热化学方程式.
写出下列反应的热化学方程式.