题目内容
20.原子序数依次增大的X、Y、Z、G、Q、R六种主族元素,核电荷数均小于36.已知X的一种1:2型氢化物分子中既有σ键又有π键,且所有原子共平面;Z的L层上有2个未成对电子;Q原子s能级与p能级电子数相等;R单质是制造各种计算机、微电子产品的核心材料.(1)元素X的原子核外共有6种不同运动状态的电子,有3种不同能级的电子.
(2)X、Y、Z的第一电离能由小到大的顺序为C<O<N (用元素符号表示).
(3)Z与R能形成化合物甲,1mol甲中含4mol化学键
(4)G、Q氟化物的熔点如下表,造成熔点差异的原因为NaF与MgF2为离子晶体,Mg2+的半径比Na+的半径小,电荷数高,晶格能MgF2>NaF,故MgF2的熔点比NaF高
| 氟化物 | G的氟化物 | Q的氟化物 |
| 熔点/K | 993 | 1539 |
分析 原子序数依次增大的X、Y、Z、G、Q、R六种主族元素,核电荷数均小于36.由X的一种1:2型氢化物分子中既有σ键又有π键,且所有原子共平面,可知氢化物为乙烯,则X为C元素;Z的L层上有2个未成对电子,L层电子排布为2s22p4,则Z为O元素,结合原子序数可知Y为N;Q原子s能级与p能级电子数相等,则Q的电子排布为1s22s22p63s2,则Q为Mg元素,R单质是制造各种计算机、微电子产品的核心材料,R为Si,结合G的原子序数及形成氟化物可知G为Na,以此来解答.
解答 解:由上述分析可知,X为C,Y为N,Z为O,G为Na,Q为Mg,R为Si,
(1)C的电子排布为1s22s22p2,共有6种不同运动状态的电子,有1s、2s、2p共3种不同能级的电子,故答案为:6;3;
(2)非金属性越强,第一电离能越大,但N的2p电子半满为稳定结构,则X、Y、Z的第一电离能由小到大的顺序为C<O<N,故答案为:C<O<N;
(3)Z与R能形成化合物甲为SiO2,1个Si的周围有4个Si-O键,1mol甲中含4mol化学键,故答案为:4;
(4)由表格数据可知,Q的氟化物熔点高,造成熔点差异的原因为NaF与MgF2为离子晶体,Mg2+的半径比Na+的半径小,电荷数高,晶格能MgF2>NaF,故MgF2的熔点比NaF高,故答案为:NaF与MgF2为离子晶体,Mg2+的半径比Na+的半径小,电荷数高,晶格能MgF2>NaF,故MgF2的熔点比NaF高.
点评 本题考查原子结构与元素周期律,为高频考点,把握原子序数、电子排布规律来推断元素为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.

练习册系列答案
 同步练习强化拓展系列答案
同步练习强化拓展系列答案
相关题目
14.在体积为1L密闭容器中充入3mol的H2和1mol的N2,经测定反应开始后3s末的v(H2)=0.3mol/(L•s),则3s末H2的浓度为( )
| A. | 0.9mol/L | B. | 1.8mol/L | C. | 2.1mol/L | D. | 1.2mol/L |
8. 某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定.
某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定.
(1)将一定量纯净的氨基甲酸铵固体置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)?2NH3(g)+CO2(g).实验测得不同温度下的平衡数据列于如表:
①可以判断该分解反应已经达到化学平衡的是BC;
A.2v(NH3)═v(CO2)
B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变
D.密闭容器中氨气的体积分数不变
②根据表中数据,列式计算25.0℃时氨基甲酸铵的分解平衡常数1.6×10-8(mol•L-1)3;
③取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25℃下达到分解平衡.若在恒温下压缩容器体积,氨基甲酸铵固体的质量增大(填“增加”、“减小”或“不变”);
④氨基甲酸铵分解反应的焓变△H>0;
(2)已知:NH2COONH4+2H2O?NH4HCO3+NH3•H2O.该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO-)随时间变化趋势如图所示.
⑤计算25℃时,0~6min氨基甲酸铵水解反应的平均速率0.05mol/(L•min);
⑥根据图中信息,如何说明水解反应速率随温度升高而增大25℃反应物起始浓度较小,但0~6min的平均反应速率(曲线的斜率)仍比15℃大.
 某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定.
某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定.(1)将一定量纯净的氨基甲酸铵固体置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)?2NH3(g)+CO2(g).实验测得不同温度下的平衡数据列于如表:
| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强(kPa) | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度 (×10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
A.2v(NH3)═v(CO2)
B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变
D.密闭容器中氨气的体积分数不变
②根据表中数据,列式计算25.0℃时氨基甲酸铵的分解平衡常数1.6×10-8(mol•L-1)3;
③取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25℃下达到分解平衡.若在恒温下压缩容器体积,氨基甲酸铵固体的质量增大(填“增加”、“减小”或“不变”);
④氨基甲酸铵分解反应的焓变△H>0;
(2)已知:NH2COONH4+2H2O?NH4HCO3+NH3•H2O.该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO-)随时间变化趋势如图所示.
⑤计算25℃时,0~6min氨基甲酸铵水解反应的平均速率0.05mol/(L•min);
⑥根据图中信息,如何说明水解反应速率随温度升高而增大25℃反应物起始浓度较小,但0~6min的平均反应速率(曲线的斜率)仍比15℃大.

 .
. .
. +
+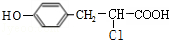 $→_{△}^{催化剂}$
$→_{△}^{催化剂}$ +HCl.
+HCl. ;写出化合物EDA的电子式
;写出化合物EDA的电子式 .
.