题目内容
硫铁矿烧渣(主要成分Fe2O3、Fe3O4、FeO、SiO2)等是工业生产硫酸的废渣,利用硫铁矿烧渣制备铁红等产品的流程如图所示: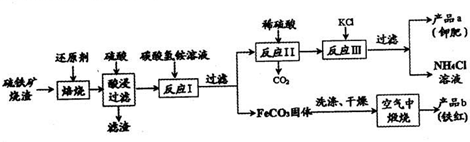
(1)硫铁矿烧渣焙烧时所添加的还原剂最有可能的是
A、铝 B、锌 C、碳
(2)酸浸、过滤后滤液中的主要成分是
(3)反应Ⅰ的反应温度一般需控制在35℃以下,其目的是
(4)空气中煅烧FeCO3生成产品b的化学反应方程式为
(5)检验产品a中是否含有氯化物杂质的实验操作时:取少量产品a于试管中配成溶液,
分析:硫铁矿烧渣在灼烧时加入碳,发生氧化还原反应生成铁,加入硫酸后生成硫酸亚铁,过滤后得到的滤渣为二氧化硅,滤液中加入碳酸氢铵溶液,可生成碳酸亚铁固体,经洗涤、干燥,在空气中灼烧时发生分解,且与空气中的氧气发生氧化还原反应,可生成铁红,反应Ⅰ过滤后所得溶液为硫酸铵和碳酸氢铵的混合物,加入硫酸得到硫酸铵,加入氯化钾可得到氯化铵和硫酸钾,以此解答该题.
解答:解:(1)硫铁矿烧渣焙烧时所添加的还原剂最有可能的是碳,如加入铝、锌,可引入新杂质,而加入碳被氧化生成CO2气体,不会引入新杂质,故答案为:C;
(2)焙烧后的固体为铁和二氧化硅的混合物,加入硫酸生成硫酸亚铁,如硫酸过量,则滤液中还含有硫酸,故答案为:FeSO4 (或H2SO4和FeSO4);
(3)为防止NH4HCO3分解(或减少Fe2+的水解),反应Ⅰ的反应温度一般需控制在35℃以下,故答案为:防止NH4HCO3分解(或减少Fe2+的水解);
(4)空气中煅烧FeCO3生成铁红,反应的方程式为4FeCO3 +O2
2Fe2O3 +4CO2,故答案为:4FeCO3 +O2
2Fe2O3 +4CO2;
(5)产品a主要为硫酸钾,为检验是否含有氯化物杂质,应加入硝酸银,但在加入硝酸银之前应加入过量的硝酸钡溶液,以除去硫酸根离子,过滤后再加入硝酸银溶液,故答案为:滴加过量Ba(NO3)2溶液,过滤后向滤液中滴加AgNO3溶液.
(2)焙烧后的固体为铁和二氧化硅的混合物,加入硫酸生成硫酸亚铁,如硫酸过量,则滤液中还含有硫酸,故答案为:FeSO4 (或H2SO4和FeSO4);
(3)为防止NH4HCO3分解(或减少Fe2+的水解),反应Ⅰ的反应温度一般需控制在35℃以下,故答案为:防止NH4HCO3分解(或减少Fe2+的水解);
(4)空气中煅烧FeCO3生成铁红,反应的方程式为4FeCO3 +O2
| ||
| ||
(5)产品a主要为硫酸钾,为检验是否含有氯化物杂质,应加入硝酸银,但在加入硝酸银之前应加入过量的硝酸钡溶液,以除去硫酸根离子,过滤后再加入硝酸银溶液,故答案为:滴加过量Ba(NO3)2溶液,过滤后向滤液中滴加AgNO3溶液.
点评:本题考查物质的制备,侧重于学生的分析能力和实验能力的考查,为高考常见题型和高频考点,注意把握实验的流程和制备原理,难度中等.

练习册系列答案
相关题目

①装置A中可以选用下列试剂中的____(填写序 号字母);
a.(NH4)2SO4和生石灰 b.NH4Cl和Ca(OH)2固体 c.NH4HCO3固体 d.NH4Cl固体
②装置C中试剂最好选用_________(填写试剂名称);
③收集NH3时,气体应由_____(填写导管口代号)通入。
(4)写出氨水与NH4HCO3溶液反应的离子方程式_______________________
a.(NH4)2SO4和生石灰 b.NH4Cl和Ca(OH)2固体 c.NH4HCO3固体 d.NH4Cl固体
②装置C中试剂最好选用_________(填写试剂名称);
③收集NH3时,气体应由_____(填写导管口代号)通入。
(4)写出氨水与NH4HCO3溶液反应的离子方程式_______________________



