题目内容
运用元素周期律分析下面的推断,其中不正确的是( )。
| A.锂(Li)与水反应比钠与水反应剧烈 |
| B.砹(At)为有色固体,AgAt难溶于水也不溶于稀硝酸 |
| C.在氧气中,铷(Rb)的燃烧产物比钠的燃烧产物更复杂 |
| D.HBrO4的酸性比HIO4的酸性强 |
A
解析试题分析:A.同一主族的元素,从上到下,元素的原子半径逐渐增大,元素的金属性逐渐增强,非金属性逐渐减弱。所以与水发生反应的剧烈程度逐渐增强。由于金属性Li<Na,所以锂(Li)与水反应不如钠与水反应剧烈。错误。B.砹(At)为卤素。同一主族的元素,从上到下,元素的单质的颜色逐渐加深。AgX的溶解度逐渐减小,颜色也逐渐加深,所以AgAt难溶于水也不溶于稀硝酸。正确。C.Li燃烧产物为Li2O;Na的燃烧产物为Na2O、Na2O2;K燃烧产物还有KO2。可见元素的金属性越强,其燃烧产物月复杂。由于金属活动性Rb>K。所以铷(Rb)的燃烧产物比钠的燃烧产物更复杂。正确。D.Br、I是同一主族的元素,由于非金属性Br>I,元素的非金属性越强,其最高价氧化物对应的水化物的酸性就越强。所以HBrO4的酸性比HIO4的酸性强。正确。
考点:考查元素周期律的应用的知识。

练习册系列答案
相关题目
下列化合物中阴离子半径和阳离子半径之比最大的是 ( )
| A.LiI | B.NaBr | C.KCl | D.CsF |
依据元素周期表及元素周期律,下列推断中正确的是
| A.同一周期元素的原子,半径越小越容易失去电子 |
| B.ⅠA族元素的金属性比ⅡA族元素的金属性强 |
| C.向氢硫酸溶液中滴入氯水有单质硫生成,可以验证硫元素的非金属性比氯元素弱 |
| D.主族元素的最高正化合价等于该元素原子的核外电子数 |
下列关于3 2He的说法正确的是
| A.3 2He原子核内含有2个中子 | B.3 2He原子核内含有3个质子 |
| C.3 2He原子核外有3个电子 | D.3 2He和4 2He是两种不同的核素 |
在下列元素中,原子半径最小的是
| A.C | B.N | C.O | D.F |
下列性质的递变中,正确的是
| A.O、S、Na的原子半径依次增大 |
| B.HF、NH3、SiH4的稳定性依次增强 |
| C.LiOH、KOH、CsOH的碱性依次增强 |
| D.HCl、HBr、HI的还原性依次减弱 |
铋(Bi)在医药方面有重要应用。下列关于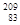 Bi和
Bi和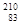 Bi的说法正确的是( )
Bi的说法正确的是( )
A.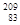 Bi和 Bi和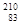 Bi都含有83个中子 Bi都含有83个中子 |
B.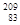 Bi和 Bi和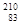 Bi互为同位素 Bi互为同位素 |
C.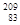 Bi和 Bi和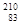 Bi的核外电子数不同 Bi的核外电子数不同 |
D.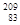 Bi和 Bi和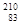 Bi分别含有126和127个质子 Bi分别含有126和127个质子 |
如图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是( )
| A.原子半径:Z>Y>X |
| B.气态氢化物的稳定性R>W |
| C.WX3和水反应形成的化合物是离子化合物 |
| D.Y和Z两者最高价氧化物对应的水化物能相互反应 |
X元素原子的质量数为m,核内中子数为n,则W g X+含有电子的物质的量(mol)是( )。
| A.(m-n)×W/m | B.(m-n-1)×W/m | C.(m+n)×W/m | D.(m-n+1)×W/m |