题目内容
常温下,pH=12的氢氧化钠溶液pH=4的醋酸溶液等体积混合后恰好中和,忽略混合后溶液体积的变化,下列说法中正确的是
| A.混合前的醋酸约1%发生电离 | B.混合后的溶液中 |
| C.氢氧化钠和醋酸和浓度不相等 | D.混合后的溶液呈中性 |
A
解析试题分析:A、等体积混合后,二者恰好中和,说明醋酸的浓度和氢氧化钠的浓度相同,都是0.01mol?L?1,醋酸溶液的pH=4,则H+浓度为0.0001mol?L?1,所以混合前醋酸电离程度为:0.0001mol/L÷0.0mol/L×100%=1%,正确;B、因为醋酸是弱酸,反应后醋酸钠水解显碱性,所以c(Na+)>c(CH3COO?),错误;C、由A项分析可知醋酸的浓度和氢氧化钠的浓度相同,错误;D、反应后醋酸钠水解显碱性,错误。
考点:本题考查酸碱中和反应、盐类的水解。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
对pH值相同的盐酸和醋酸两种溶液的说法正确的是
| A.中和碱的能力相同 | B.盐酸和醋酸的物质的量浓度相同 |
| C.OH-的物质的量浓度相同 | D.H+的物质的量浓度不同 |
已知在25℃时,FeS、CuS的溶度积常数(Ksp)分别为6.3×10-18、1.3×10-36。常温时下列
有关说法正确的是( )
| A.除去工业废水中的Cu2+可以选用FeS作沉淀剂 |
| B.向H2S的饱和溶液中通入少量SO2气体溶液的酸性增强 |
| C.因为H2SO4是强酸,所以反应:CuSO4十H2S=CuS↓+H2SO4不能发生 |
| D.将足量的CuSO4溶解在0.1 mol/L的H2S溶液中,溶液中Cu2+的最大浓度为1.3×10-35mol/L |
25℃,向一定体积0.1mol/L的醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液中c(H+)与c(OH—)的变化关系如图所示,则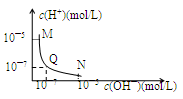
| A.M点所示溶液的导电能力强于Q点 |
| B.N点所示溶液中c(CH3COO―)>c(Na+) |
| C.Q点消耗NaOH溶液的体积等于醋酸溶液的体积 |
| D.M点和N点所示溶液中H2O的电离程度相同 |
0.1 mol·L-1NaOH溶液和0.1 mol·L-1NH4C1溶液等体积混合,离子浓度大小正确的是
| A.c(Na+)>c(C1-)>c(OH-)>c(H+) |
| B.c(Na+)=c(C1-)>c(OH-)>c(H+) |
| C.c(Na+)=c(C1-)>c(H+)>c(OH-) |
| D.c(C1-)>c(Na+)>c(OH-)>c(H+) |
中和滴定是一种操作简单,准确度高的定量分析方法。实际工作中也可以利用物质间的氧化还原反应、沉淀反应进行类似的滴定分析,这些滴定分析均需要通过指示剂来确定滴定终点,下列对几种具体的滴定分析(待测液置于锥形瓶内)中所用指示剂及滴定终点时的溶液颜色的判断不正确的是
| A.用标准NaOH溶液滴定盐酸溶液以测定其浓度:酚酞试液——浅红色 |
| B.用标准FeCl3溶液滴定KI以测定其浓度:淀粉溶液——蓝色 |
| C.用标准酸性KMnO4溶液滴定Na2SO3溶液以测定其浓度:KMnO4溶液——紫红色 |
| D.利用“Ag++SCN-=AgSCN↓”原理,用标准KSCN溶液滴定AgNO3溶液以测定其浓度:FeCl3溶液——红色 |
关于浓度均为0.1 mol·L-1的三种溶液:①氨水、②盐酸、③氯化铵溶液,下列说法不正确的是
| A.c(NH4+):③>① |
| B.水电离出的c(H+):②>① |
| C.①和②等体积混合后的溶液:c(H+)=c(OH-)+c(NH3·H2O) |
| D.①和③等体积混合后的溶液:c(NH4+)>c(Cl-)>c(OH-)>c(H+) |
下列液体均处于25 ℃,有关叙述正确的是( )
| A.Na2CO3溶液中,c(OH-)-c(H+)=c(HCO3-) +2c(H2CO3) |
| B.AgCl在同浓度的MgCl2和KCl溶液中的溶解度相同 |
| C.将稀氨水逐滴加入稀硫酸中,当溶液pH =7时,c(SO42-) >c(NH4+) |
| D.Na2S溶液加水稀释后,恢复至原温度,pH和Kw均减小 |