题目内容
【题目】以熔融Li2CO3和K2CO3为电解质,天然气经重整催化作用提供反应气的燃料电池如右图。下列说法正确的是
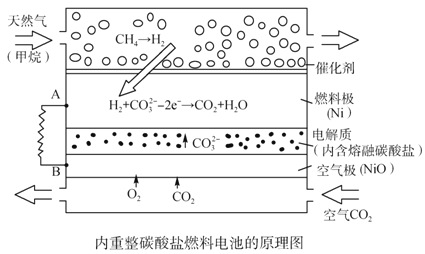
A. 以此电池为电源电解精炼铜,当有0.1 mol e- 转移时,有3.2 g铜溶解
B. 若以甲烷为燃料气时负极电极反应式:CH4+5O2--8e-=CO32-+2H2O
C. 该电池使用过程中需补充Li2CO3和K2CO3
D. 空气极发生的电极反应式为O2+4e-+2CO2===2CO32-
【答案】D
【解析】试题分析:A、电解精炼铜,阳极上铜和比铜活泼的金属失电子变为金属阳离子进入电解质溶液,当有0.1 mol e-转移时,若只有铜放电,则有3.2 g铜溶解,粗铜有比铜更活泼的金属首先放电,所以溶解的铜小于3.2g,错误;B、根据图示信息,通入甲烷的电极是负极,在负极上,甲烷变为氢气,氢气发生失电子的氧化反应,即H2-2e-+CO32-==CO2+H2O,错误;C、该电池的电极反应为负极:H2-2e-+CO32-==CO2+H2O,正极:O2+4e-+2CO2==2CO32-,所以碳酸根离子的浓度不变,该电池使用过程中不需补充Li2CO3和K2CO3,错误;D、通入空气和CO2的混合气体一极为原电池的正极,发生还原反应,电极反应式为O2+4e-+2CO2==2CO32-,正确。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目