题目内容
19.某厂生产的BaCO3因含少量BaSO4而不纯,提纯的方法是;将产品加入足量的饱和Na2CO3溶液中,充分搅拌,过滤,若用100.0LNa2CO3溶液溶解1.0mol的BaSO4,则Na2CO3溶液的最初浓度不得低于[已知Ksp(BaSO4)=1.1×10-10;Ksp(BaCO3)=2.6×10-9]( )| A. | 0.24mol•L-1 | B. | 0.25mol•L-1 | C. | 0.34mol•L-1 | D. | 0.35mol•L-1 |
分析 用100.0LNa2CO3溶液溶解1.0mol的BaSO4,发生反应为CO32-+BaSO4?BaCO3+SO42-,该反应的平衡常数K=$\frac{c(S{{O}_{4}}^{2-})}{c(C{{O}_{3}}^{2-})}$=$\frac{{K}_{sp}(BaS{O}_{4})}{{K}_{sp}(BaC{O}_{3})}$;1.0molBaSO4完全溶解生成n(SO42-)=1.0mol,c(SO42-)=$\frac{1.0mol}{100.0L}$=0.01mol/L,结合溶解平衡表达式计算出碳酸钠的浓度.
解答 解:碳酸钠与硫酸钡反应转化成碳酸钡的反应为:CO32-+BaSO4?BaCO3+SO42-,
该反应的平衡常数为:K=$\frac{c(S{{O}_{4}}^{2-})}{c(C{{O}_{3}}^{2-})}$=$\frac{{K}_{sp}(BaS{O}_{4})}{{K}_{sp}(BaC{O}_{3})}$=$\frac{1.1×1{0}^{-10}}{2.6×1{0}^{-9}}$=$\frac{11}{260}$≈0.0423,
1.0molBaSO4完全溶解生成n(SO42-)=1.0mol,c(SO42-)=$\frac{1.0mol}{100.0L}$=0.01mol/L,
所以c(Na2CO3)=c(CO32-)=$\frac{0.01mol}{0.0423}$≈0.24mol/L,
故选A.
点评 本题考查了难溶物溶解平衡的有关计算,题目难度中等,明确溶解平衡常数的概念及表达式为解答关键,试题侧重考查学生的分析、理解能力及化学计算能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
14.下列有关实验的操作或判断正确的是 ( )
| A. | 取少量浑浊的天然水,加入适量明矾,天然水变得澄清透明 | |
| B. | 分别通过盛有品红溶液的洗气瓶可以鉴别SO2和CO2 | |
| C. | 保存硅酸钠溶液可以使用磨口玻璃塞、细口玻璃瓶 | |
| D. | 向Fe(OH)3胶体中逐滴加入过量的稀盐酸,先生成红褐色沉淀,最后沉淀又溶解 | |
| E. | 用镊子从煤油中夹取小块金属钠直接投入水中 |
4.某核素的质量数为A,其阴离子Xn-核外有x个电子.有关该微粒的描述正确的是( )
| A. | Xn-的原子核内一定有(A-x-n)个中子 | |
| B. | Xn-的原子核内一定有(x-n)个质子 | |
| C. | Xn-的最外层一定具有8电子稳定结构 | |
| D. | Xn-的次外层一定排布了8个电子 |
11.在实验室中,能达到目的是( )
| A. | 用金属钠分别与同浓度苯酚和乙醇的水溶液反应,比较两者羟基氢(-OH)的活泼性 | |
| B. | 石墨作电极,电解Cu(NO3)2、AgNO3 的混合溶液,比较金属铜和银的金属活动性 | |
| C. | 分别测定CH4 和H2S 的沸点高低,比较硫和碳两种元素的非金属性强弱 | |
| D. | 用检验Na2CO3 和Na2SO3 水溶液酸碱性实验,比较碳和硫两元素非金属性的强弱 |
9.为除去括号内的杂质,所选用的试剂或方法不正确的是( )
| A. | Na2CO3粉末(NaHCO3),加热直至固体质量不再减少 | |
| B. | NaHCO3溶液(Na2CO3),向溶液中通入过量的CO2气体 | |
| C. | CO2(HCl),将气体依次通过Na2CO3溶液和浓硫酸中 | |
| D. | H2(HCl),将气体通入碱石灰中 |
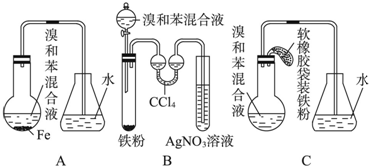
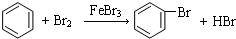 .
.
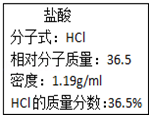 如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题: