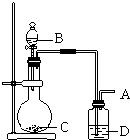
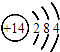题目内容
【题目】金属铈(58Ce)常用于制作稀土磁性材料,可应用于制造玻璃、打火石、陶瓷和合金等。已知:Ce4++Fe2+=Ce3+ +Fe3+。下列说法正确的是
A. 可用电解熔融CeO2制取金属铈,铈在阳极生成
B. ![]() 、
、![]() 是同素异形体
是同素异形体
C. 铈的原子核外有58个电子
D. 铈能溶于HI溶液,发生反应的离子方程式为:Ce+4H+=Ce4++2H2
【答案】C
【解析】A.若电解熔融CeO2制取金属铈,只能在阴极发生还原反应生成铈,阳极上发生的是氧化反应,A不正确;B. ![]() 、
、![]() 是同位素,B不正确;C. 铈的质子数为58,原子核外有58个电子,C正确;D. Ce4+的氧化性非常强,HI溶液中的I-还原性很强,所以铈溶于HI溶液不可能生成Ce4+,D不正确。本题选C。
是同位素,B不正确;C. 铈的质子数为58,原子核外有58个电子,C正确;D. Ce4+的氧化性非常强,HI溶液中的I-还原性很强,所以铈溶于HI溶液不可能生成Ce4+,D不正确。本题选C。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】(1)利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤。已知:SO2(g) +1/2O2(g)![]() SO3(g) △H=-98 kJ·mol-1。某温度下该反应的平衡常数K=10/3,若在此温度下,向100 L的恒容密闭容器中,充入3.0 mol SO2(g)、16.0 mol O2(g)和3.0 mol SO3(g),则反应开始时v(正) _____v(逆)(填“<”、“>”或“=”)。
SO3(g) △H=-98 kJ·mol-1。某温度下该反应的平衡常数K=10/3,若在此温度下,向100 L的恒容密闭容器中,充入3.0 mol SO2(g)、16.0 mol O2(g)和3.0 mol SO3(g),则反应开始时v(正) _____v(逆)(填“<”、“>”或“=”)。
(2)下表列出了常见的烟气脱硝的两种方法
编号 | 名称 | 原理 |
方法一 | 尿素法 | 在温度70—95℃时,尿素CO(NH2)2溶液吸收NO、NO2,将其转化为N2 |
方法二 | 选择性催化还原( SCR)法 | 以NH3等作为还原剂,将烟气中的NOx还原生成N2和H2O |
已知:N2(g)+O2(g)=2NO(g) △H=+180.6 kJ·mol—1
N2(g)+3H2(g)=2NH3(g) △H= -92.4kJ·mol—1
2H2(g)+O2(g)=2H2O(g)△H= -483.6 kJ·mol—1
则4NO(g) +4NH3(g)+O2(g)=4N2(g)+6H2O(g);△H=_________ kJ·mol-1。
(3)CO和H2在一定条件下合成甲醇的反应为:CO(g)+2H2(g) ![]() CH3OH(g);ΔH。现在容积均为1L的a、b、c、d、e五个密闭容器中分别充入1molCO和2molH2的混合气体,控温,进行实验,测得相关数据如下图1和图2。
CH3OH(g);ΔH。现在容积均为1L的a、b、c、d、e五个密闭容器中分别充入1molCO和2molH2的混合气体,控温,进行实验,测得相关数据如下图1和图2。

①该反应的ΔH_______0(选填“<”、“>”或“=”,下同),K1_________K2。
②将容器c中的平衡状态转变到容器d中的平衡状态,可采取的措施有___。