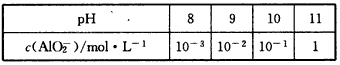
题目内容
| |||||||||||||||
答案:
解析:
解析:
(1) |
否,当PH=9时代入,c(Mg2+)=0.1 mol/L,浓度未变,则未形成Mg(OH)2沉淀. |
(2) |
-l g c(AlO2-)+PH=11 |
(3) |
196 g |

练习册系列答案
 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案
相关题目
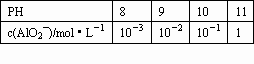
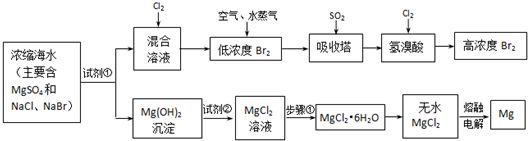
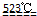 MgO+2 HCl↑+5H2O↑
MgO+2 HCl↑+5H2O↑