题目内容
下列操作中,能使电离平衡H2O H++OH-向右移动且溶液呈酸性的是
H++OH-向右移动且溶液呈酸性的是
| A.向水中加入NaHSO4溶液 | B.向水中加入Al2(SO4)3固体 |
| C.向水中加入Na2CO3溶液 | D.将水加热到100℃,使pH=6 |
B
解析试题分析:A NaHSO4=Na++H++SO42-.加入NaHSO4溶液后,C(H+) 增大,水的电离平衡向逆向移动。错误。B.向水中加入Al2(SO4)3固体 ,发生反应Al3++3H2O Al(OH)3+3H+ .由于消耗了水电离生成的OH-,使平衡正向移动,产生的OH-又被消耗。当最终达到电离平衡时,C(H+)>C(OH-)。正确。C.向水中加入Na2CO3溶液发生反应:CO32-+H2O
Al(OH)3+3H+ .由于消耗了水电离生成的OH-,使平衡正向移动,产生的OH-又被消耗。当最终达到电离平衡时,C(H+)>C(OH-)。正确。C.向水中加入Na2CO3溶液发生反应:CO32-+H2O HCO3-+OH-。.由于消耗了水电离生成的H+,使平衡正向移动,产生的H+-又被消耗。当最终达到电离平衡时,C(OH-) > C(H+)。错误。
HCO3-+OH-。.由于消耗了水电离生成的H+,使平衡正向移动,产生的H+-又被消耗。当最终达到电离平衡时,C(OH-) > C(H+)。错误。
考点:考查外界条件对水的电离平衡的影响的知识。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案实验表明,相同温度下,液态纯硫酸的导电性强于纯水。下列关于相同温度下纯硫酸的离子积常数K和水的离子积常数Kw关系的描述正确的是
| A.K> Kw | B.K= Kw | C.K< Kw | D.无法比较 |
.下列叙述正确的是
| A.c(NH4+)相等的(NH4)2SO4溶液、(NH4)2Fe(SO4)2溶液和NH4Cl溶液中,溶质浓度大小关系是:c[(NH4)2Fe(SO4)2] < c[(NH4)2SO4] < c(NH4Cl) |
| B.向AgCl悬浊液中滴入KI溶液,有AgI沉淀生成,说明AgCl的溶解度小于AgI的溶解度 |
| C.室温下,0.2 mol?L-1盐酸与等体积0.05 mol?L-1Ba(OH)2溶液混合后,溶液的pH=1 |
| D.0.2 mol?L-1的NaHCO3溶液中c(H+)+c(H2CO3)=2c(CO32-)+c(OH-) |
室温下,向0.1 mol·L-1的硫酸溶液中逐滴加入物质的量浓度相同的氢氧化钡溶液,生成沉淀的量与加入氢氧化钡溶液的体积关系如图所示,a、b、c、d分别表示实验时不同阶段的溶液,下列有关说法中不正确的是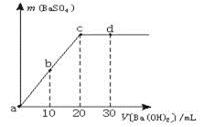
| A.溶液的pH:a<b<c<d |
| B.溶液的导电能力:a>b>d>c |
| C.a、b溶液呈酸性 |
| D.c、d溶液呈碱性 |
下列溶液中各微粒的浓度关系不正确的是
| A.0.1mol/LHCOOH溶液中:c(HCOO-)+c(OH-) = c(H+) |
| B.1L0.1 mol/LCuSO4·(NH4)2SO4·6H2O的溶液中c(SO42->c(NH4+)>c(Cu2+)>c(H+)>c(OH-) |
| C.0.1mol/LNaHCO3溶液中:c(Na+)+c(H+)+c(H2CO3)>c(HCO3-)+c(CO32-)+c(OH-) |
| D.等体积、等物质的量浓度的NaX和弱酸HX混合后的溶液中:c(Na+)>c(HX)>c(X-)>c(H+)>c(OH-) |
下列叙述正确的是
| A.NaHCO3溶液中:c(H+) + c(Na+)=c(HCO3-)+2c(CO32-) + c(OH-) |
| B.pH=12的Ba(OH)2溶液和pH=12的Na2CO3溶液中,水电离的c(H+)一样多 |
| C.0.2mol·L-1 HCl溶液与等体积0.05 mol·L-1 Ba(OH)2溶液混合后,溶液的pH=1 |
| D.向10 mL 0.10mol?L-1CH3COOH溶液加入等物质的量的NaOH后,溶液中离子的浓度由大到小的顺序是:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
常温下,将pH和体积都相同的盐酸和醋酸溶液分别加蒸馏水稀释,pH随溶液体积变化如图,下列有关叙述正确的是
| A.曲线I为醋酸稀释时pH值变化曲线 |
| B.a点时,若都加入相同大小的锌粒,此时盐酸反应的速率大 |
| C.a点时,若都加入足量的锌粒,最终与醋酸反应产生的氢气多 |
| D.b点溶液中水的电离程度比c点溶液中水的电离程度小 |
下列有关问题,与盐的水解有关的是
① NH4Cl与ZnCl2溶液可作焊接金属中的除锈剂
② 用NaHCO3与Al2(SO4)3两种溶液可作泡沫灭火剂
③ 草木灰与铵态氮肥不能混合施用
④ 实验室盛放碳酸钠溶液的试剂瓶不能用磨口玻璃塞
⑤ 加热蒸干AlCl3溶液得到Al(OH)3固体
| A.①②③ | B.②③④ | C.①④⑤ | D.①②③④⑤ |
将常温下pH=12的氢氧化钠溶液与pH=2的硫酸溶液分别加热,溶液pH的变化是
| A.前者减小后者不变 | B.前者减小后者增大 | C.都不变 | D.都减小 |