题目内容
铜在自然界中多以+1价矿石存在,因在固态特别是高温下,+1价铜的化合物比+2价稳定。从辉铜矿(Cu2S)炼铜的方法之一是:①将矿石高温通空气焙烧,生成两种氧化物。②将焙烧过的矿石加上比它质量约少一半的未经过焙烧的矿石,混合后隔绝空气再进行高温煅烧,结果得到金属铜和另外一种具有刺激性气味的气体。写出这两个反应的化学方程式:(1)_________________________,
(2)_________________________。
(1)2Cu2S+3O2![]() 2Cu2O+2SO2↑
2Cu2O+2SO2↑
(2)2Cu2O+Cu2S![]() 6Cu+SO2↑
6Cu+SO2↑

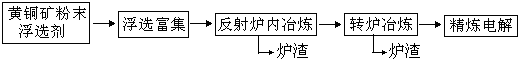
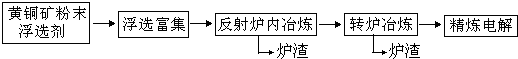
(16分)铜在自然界中存在于多种矿石中,如
| 矿石名称 | 黄铜矿 | 斑铜矿 | 辉铜矿 | 孔雀石 |
| 主要成分 |
|
|
|
|
请回答以下问题:
(1)上表所列铜的化合物中,铜的质量分数最高的是______________(填化学式)。
(2)工业上以黄铜矿为原料,采取火法熔炼工艺生产铜。该过程中有如下反应:
![]() ,该反应的还原剂是____________;若在标准状况下放出气体56L,则转移电子的物质的量为_____________。
,该反应的还原剂是____________;若在标准状况下放出气体56L,则转移电子的物质的量为_____________。
(3)某同学采集酸雨样品并测其pH,发现在一段时间内其pH逐渐减小。请用必要的文字和化学方程式说明其原因______________________________________________
________________________________________________________。
(4)铜制品长期置于潮湿的环境中,表面会产生一层铜绿,其主要成分与孔雀石相同。
请写出采用化学方法除去铜器表面铜绿的有关反应的离子方程式:_____________
_______________________________________________。
(5)![]() 与
与![]() 都是红色粉末。
都是红色粉末。![]() 溶于稀
溶于稀![]() 会生成
会生成![]() 和
和![]() 。一同学为鉴定某
。一同学为鉴定某![]() 样品中是否混有多少量的
样品中是否混有多少量的![]() ,设计了如下实验:取少量粉末放入足量稀
,设计了如下实验:取少量粉末放入足量稀![]() 中,向所得溶液中滴加
中,向所得溶液中滴加![]() 试剂。该同学通过实验认为:若滴加KSCN试剂后溶液不变红色,则证明原固体粉末中一定不含
试剂。该同学通过实验认为:若滴加KSCN试剂后溶液不变红色,则证明原固体粉末中一定不含![]() 。你认为这种说法是否正确___________:简述你的理由(用离子方程式表示):______________,
。你认为这种说法是否正确___________:简述你的理由(用离子方程式表示):______________,
如果要得到准确的结论,还需加入的一种试剂是_________________。
 2FeO+2SO2
2FeO+2SO2