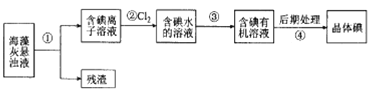
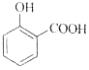
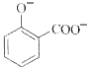
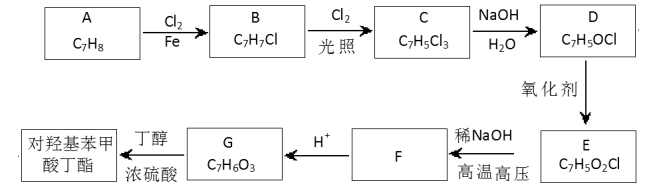
题目内容
【题目】有一无色透明强酸性溶液,可能含K+、NH4+、Al3+、Cu2+、Fe2+、SO42-、SiO32-、CO32-、NO3-等离子中的若干种,现做如下实验:
①取少量该溶液,加入足量用稀硝酸酸化的BaCl2溶液,有白色沉淀生成。
②另取①中上层澄清溶液,加入氢氧化钠溶液,生成沉淀的物质的量随NaOH溶液的体积变化的图象如下所示。
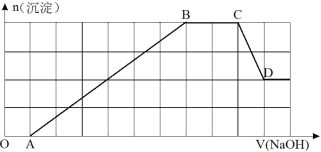
请完成下列问题:
(1)原溶液中一定存在(H+、OH-不必写出)___________,一定不存在________________,可能存在____________。
(2)原溶液中肯定含有的阳离子(H+除外)物质的量之比为________________。
(3)步骤①中若有氧化还原反应请写出对应离子方程式(若无,填写“无”)________________。
(4)若已知步骤②中最终形成1mol沉淀。现取原溶液加入足量的NaOH溶液,充分反应后过滤,洗涤,灼烧至恒重,得到的固体质量为 g。
【答案】(1) NH4+、Al3+、Fe2+、SO42-;Cu2+、SiO32-、CO32-、NO3- K+
(2) n(Al3+):n(Fe2+): n(NH4+)=1:1:2
(3)3Fe2+ + 4H+ + NO3- =3Fe3+ + NO↑+ 2H2O (4) 80
【解析】
试题分析:(1)无色透明溶液中不可以存在有色离子,所以Cu2+一定不存在,H2SiO3不溶于水,SiO32-不存在,CO32-不存在,①取少量该溶液,加入足量用稀硝酸酸化的BaCl2溶液,有白色沉淀生成,说明溶液中含有SO42-;②另取①中上层澄清溶液,加入氢氧化钠溶液,根据生成沉淀的物质的量随NaOH溶液的体积变化的图象可知,生成沉淀后,沉淀部分溶解,一定含有Al3+,没溶解的沉淀应该是Fe(OH)3沉淀,所以一定含有Fe2+,有一段时间消耗氢氧化钠但是沉淀的量不增加说明含有NH4+,溶液中存在Fe2+说明一定没有NO3-,K+可能存在,答案为:NH4+、Al3+、Fe2+、SO42- Cu2+、SiO32-、CO32-、NO3- K+;(2)一定含有的阳离子有NH4+、Al3+、Fe2+,其中亚铁离子被硝酸氧化为铁离子,根据产生的沉淀和消耗NaOH的量可知n(Al3+):n(Fe3+):n(NH4+)=1:1:2,答案为:1:1:2;(3)步骤①中涉及到的氧化还原反应是硝酸将亚铁离子氧化为铁离子,反应的离子方程式为:3Fe2+ + 4H+ + NO3- =3Fe3+ + NO↑+ 2H2O,答案为:3Fe2+ + 4H+ + NO3- =3Fe3+ + NO↑+ 2H2O;(4)步骤②中最终形成1mol氢氧化铁沉淀,将氢氧化铁灼烧得到的是氧化铁的沉淀,根据铁元素守恒,1mol氢氧化铁的沉淀最终可以得到1.5mol氧化铁,其质量为:1.5mol×160g/mol=80g,答案为:80g.

 阅读快车系列答案
阅读快车系列答案