题目内容
(12分)化学实验室通常用粗锌和稀硫酸反应制氢气,因此在制氢废液中含有大量的硫酸锌。同时,由于粗锌中还含有铁等杂质,使得溶液中混有一定量的硫酸亚铁,为了充分利用制氢废液,常用其制备皓矾(ZnSO4·7H2O)。某校化学兴趣小组的同学以制氢气的废液为原料来制取皓矾并探究其性质。
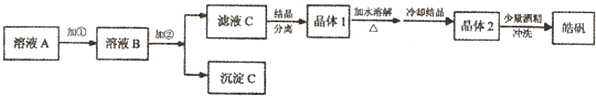
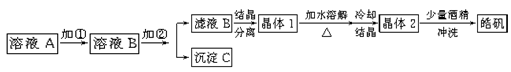
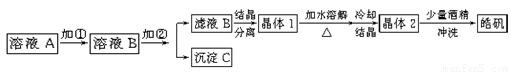
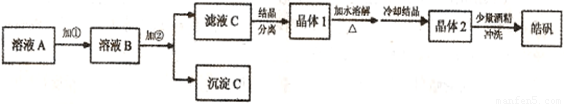 (l)制备皓矾的实验流程如下图所示。
(l)制备皓矾的实验流程如下图所示。
已知:下列氢氧化物开始生成沉淀到沉淀完全的pH范围分别为:
|
|
开始沉淀 |
沉淀完全 |
|
Fe(OH)3 |
2.7 |
3.7 |
|
Fe(OH)2 |
7.6 |
9.6 |
|
Zn(OH)2 |
5.7 |
8.0 |
回答下列问题:
可供选择使用的有:氯水、20%的H2O2、氨水、NaOH溶液、Zn(OH)2、ZnO
① 加入的试剂①,应选用 ,作用: 。
② 加入的试剂②调节pH,可选用 或 ,用离子方程式表示其原理
。
③有同学提出,应将晶体1加入稀硫酸中溶解,原因是 。
④在得到皓矾时,向晶体中加入少量酒精洗涤而不用水的原因是 。
(2)检验皓矾中是否含有Fe元素的操作(试剂自选) 。
(l)① 20%的H2O2(1分);Fe2+氧化为Fe3+,方便除杂(1分)
②ZnO或Zn(OH)2(各1分);Fe3++3H2O Fe(OH)3+3H+ ZnO+2H+=
Zn2++H2O(2分)。③稀硫酸可抑制ZnSO4的水解,防止产生Zn(OH)2杂质(2分)
Fe(OH)3+3H+ ZnO+2H+=
Zn2++H2O(2分)。③稀硫酸可抑制ZnSO4的水解,防止产生Zn(OH)2杂质(2分)
④防止晶体溶解,减少损失(2分)。
(2)取少量皓矾溶于水配制成溶液,往所得溶液中滴加几滴氯水,再加入适量KSCN溶液,如无明显现象说明不含Fe3+,如溶液变为红色则说明含Fe3+。(2分)
【解析】
试题分析:(1)该制备流程首先为除去废液中的Fe杂质,然后得到含Zn2+的溶液,接着,就是结晶,溶解,结晶,洗涤。由沉淀PH范围可知,把Fe2+氧化成Fe3+,更方便除杂。加入试剂②调节pH,选用既可以达到这目的的,也要满足能不带进杂质。ZnSO4能够水解,故加入稀硫酸,利用同离子效应可以抑制水解,防止产生Zn(OH)2杂质。
(2)检验是否含有铁元素,可以取少量皓矾溶于水配制成溶液,往所得溶液中滴加几滴氯水,再加入适量KSCN溶液,如无明显现象说明不含Fe3+,如溶液变为红色则说明含Fe3+。
考点:Fe元素的除杂及防水解问题
点评:此题考核了利用调节PH来除杂的问题,要遵从不带进其他杂质的原则,同时要注意对于弱酸碱盐,要防止它的水解。