题目内容
过氧化氢是重要的工业产品和实验室常用试剂.(1)制取H2O2的方法很多,下列制取方法具有绿色环保,原子利用率最高的是
a.BaO2+H2SO4=BaSO4↓+H2O2
b.K2S2O8+2H2O=2KHSO4+H2O2
c.Na2O2+H2SO4+10H2O=Na2SO4?10H2O+H2O2
d.
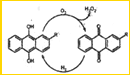
(2)H2O2水溶液具有弱酸性,其电离方程式为:
(3)取氢气还原氧化铜后所得红色固体产物7.80g(含有Cu和并可能含有少量Cu2O、CuO),将其均分为两等份.一份在空气中灼烧到恒重为4.86g;另一份用含17%H2O2的酸性溶液至少
(4)为测定某钙片中H2O2残留,取25片(1.0g/片),研细、溶解、配成溶液250.00mL.取25.00mL,用0.01000mol?L-1酸性高锰酸钾溶液滴定(除H2O2外,其它物质不参与反应),耗去20.00mL.则钙片中H2O2残留为
分析:(1)原子利用率最高的应是反应物全部转化为生成物,没有其它副产品的反应;
(2)根据过氧化氢呈弱酸性,能电离出氢离子解答;
(3)根据2Cu+O2
2CuO,结合得失电子守恒分析解答;
(4)KMnO4是氧化剂,H2O2是还原剂,根据反应方程式:2KMnO4+5H2O2+3H2SO4=2MnSO4+K2SO4+8H2O+5O2↑进行相关计算.
(2)根据过氧化氢呈弱酸性,能电离出氢离子解答;
(3)根据2Cu+O2
| ||
(4)KMnO4是氧化剂,H2O2是还原剂,根据反应方程式:2KMnO4+5H2O2+3H2SO4=2MnSO4+K2SO4+8H2O+5O2↑进行相关计算.
解答:解:(1)对比选项四种制备方案可知,d选项制取H2O2的反应中,反应物全部转化为生成物没有副产品,原子利用率最高,abc,反应均有其它副产品,故d正确;
故答案为:d;
(2)过氧化氢呈弱酸性,是二元弱酸,电离方程式为:H2O2?H++HO2-或2H2O2?H3O2++HO2-,
故答案为:H2O2?H++HO2-(或2H2O2?H3O2++HO2-);
(3)取氢气还原氧化铜后所得红色固体产物7.80g(含有Cu和并可能含有少量Cu2O、CuO),将其均分为两等份.第一份质量为3.90 g,在空气中灼烧到恒重为4.86g,因为2Cu+O2
2CuO,固体质量应该增加,说明一定发生,固体分成两等份,在空气中充分灼烧后,所得固体为CuO,固体增重0.96 g,则参加反应的n(O)=0.06 mol,转移的电子数为0.12 mol,另一份与H2O2酸性溶液反应,得蓝色溶液,说明产物为Cu2+,转移电子数应与前一份相同为0.12 mol,H2O2被还原为H2O,1mol过氧化氢转移2mol电子,根据得失电子守恒
×2=0.12 mol,则需17%H2O2的酸性溶液m=12.0g,
故答案为:12.0;
(4)用0.01000mol?L-1酸性高锰酸钾溶液滴定(除H2O2外,其它物质不参与反应),耗去20.00mL,高锰酸钾的物质的量为2×10-4mol,KMnO4是氧化剂,H2O2是还原剂,根据反应方程式:2KMnO4+5H2O2+3H2SO4=2MnSO4+K2SO4+8H2O+5O2↑因此2KMnO4~5H2O2消耗H2O2就是5×10-4mol,即5×10-4mol×34×103mg/mol=17mg,取25片(1.0g/片),研细、溶解、配成溶液250.00mL.取25.00mL,相当于取2.5片药片,则钙片中H2O2残留为
=6.8mg/片,
故答案为:6.8.
故答案为:d;
(2)过氧化氢呈弱酸性,是二元弱酸,电离方程式为:H2O2?H++HO2-或2H2O2?H3O2++HO2-,
故答案为:H2O2?H++HO2-(或2H2O2?H3O2++HO2-);
(3)取氢气还原氧化铜后所得红色固体产物7.80g(含有Cu和并可能含有少量Cu2O、CuO),将其均分为两等份.第一份质量为3.90 g,在空气中灼烧到恒重为4.86g,因为2Cu+O2
| ||
| m×17% |
| 34g/mol |
故答案为:12.0;
(4)用0.01000mol?L-1酸性高锰酸钾溶液滴定(除H2O2外,其它物质不参与反应),耗去20.00mL,高锰酸钾的物质的量为2×10-4mol,KMnO4是氧化剂,H2O2是还原剂,根据反应方程式:2KMnO4+5H2O2+3H2SO4=2MnSO4+K2SO4+8H2O+5O2↑因此2KMnO4~5H2O2消耗H2O2就是5×10-4mol,即5×10-4mol×34×103mg/mol=17mg,取25片(1.0g/片),研细、溶解、配成溶液250.00mL.取25.00mL,相当于取2.5片药片,则钙片中H2O2残留为
| 17mg |
| 2.5片 |
故答案为:6.8.
点评:本题考查了过氧化氢的性质,掌握过氧化氢的酸性和还原性和氧化还原计算是解答的关键,题目难度中等.

练习册系列答案
相关题目
 (2010?梅州一模)过氧化钙是重要的工业原料,350℃时能迅速分解,生成氧化钙,并放出氧气.工业上将碳酸钙溶于适量的盐酸中,在低温和碱性条件下,与过氧化氢反应制得:CaCO3+2HCl═CaCl2+CO2↑+H2O,CaCl2+H2O2+2NH3+8H2O═CaO2?8H2O↓+2NH4Cl.如图是实验室测定产品中过氧化钙含量的装置.试回答下列问题:
(2010?梅州一模)过氧化钙是重要的工业原料,350℃时能迅速分解,生成氧化钙,并放出氧气.工业上将碳酸钙溶于适量的盐酸中,在低温和碱性条件下,与过氧化氢反应制得:CaCO3+2HCl═CaCl2+CO2↑+H2O,CaCl2+H2O2+2NH3+8H2O═CaO2?8H2O↓+2NH4Cl.如图是实验室测定产品中过氧化钙含量的装置.试回答下列问题: 过氧化钙是重要的工业原料,350℃时能迅速分解,生成氧化钙,并放出氧气.工业上将碳酸钙溶于适量的盐酸中,在低温和碱性条件下,与过氧化氢反应制得:CaCO3+2HCl═CaCl2+CO2↑+H2O,CaCl2+H2O2+2NH3+8H2O═CaO2?8H2O↓+2NH4Cl.如图是实验室测定产品中过氧化钙含量的装置.试回答下列问题:
过氧化钙是重要的工业原料,350℃时能迅速分解,生成氧化钙,并放出氧气.工业上将碳酸钙溶于适量的盐酸中,在低温和碱性条件下,与过氧化氢反应制得:CaCO3+2HCl═CaCl2+CO2↑+H2O,CaCl2+H2O2+2NH3+8H2O═CaO2?8H2O↓+2NH4Cl.如图是实验室测定产品中过氧化钙含量的装置.试回答下列问题:
