题目内容
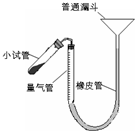
 过氧化钙是重要的工业原料,350℃时能迅速分解,生成氧化钙,并放出氧气.工业上将碳酸钙溶于适量的盐酸中,在低温和碱性条件下,与过氧化氢反应制得:CaCO3+2HCl═CaCl2+CO2↑+H2O,CaCl2+H2O2+2NH3+8H2O═CaO2?8H2O↓+2NH4Cl.如图是实验室测定产品中过氧化钙含量的装置.试回答下列问题:
过氧化钙是重要的工业原料,350℃时能迅速分解,生成氧化钙,并放出氧气.工业上将碳酸钙溶于适量的盐酸中,在低温和碱性条件下,与过氧化氢反应制得:CaCO3+2HCl═CaCl2+CO2↑+H2O,CaCl2+H2O2+2NH3+8H2O═CaO2?8H2O↓+2NH4Cl.如图是实验室测定产品中过氧化钙含量的装置.试回答下列问题:(1)上述制备工艺中,分离出主产品的操作方法是
过滤(洗涤)
过滤(洗涤)
、烘干,分离出副产品的操作方法是蒸发浓缩、冷却结晶,过滤
蒸发浓缩、冷却结晶,过滤
.(2)右图装置,检查系统是否漏气的方法是
连接好装置,从漏斗向量气筒内注入一定量的水,移动漏斗使左、右两侧形成液面高度差.静置后,液面高度不再变化,即表明气密性良好
连接好装置,从漏斗向量气筒内注入一定量的水,移动漏斗使左、右两侧形成液面高度差.静置后,液面高度不再变化,即表明气密性良好
.(3)正确读取量气管内液面的初、终读数前都需进行的操作是
移动漏斗保持左、右两侧液面相平
移动漏斗保持左、右两侧液面相平
(4)已知:样品质量m g,量气管初读数a mL,终读数b mL,该实验条件下气体摩尔体积Vm=c L?mol-1.样品中过氧化钙的含量表达式w%=
| 14.4(b-a) |
| mc |
| 14.4(b-a) |
| mc |
分析:(1)由方程式可知生成的CaO2?8H2O为沉淀,分离沉淀与溶液的操作是过滤;滤液中含有氯化铵,从溶液中获得晶体应蒸发浓缩、冷却结晶、过滤等;
(2)依据装置中气体压强变化和液体液面变化分析判断气密性;
(3)液体能产生压强,如果左右两管中液体高度不同会对实验造成影响,所以读取量气管内液面的初、终读数前都需进行移动漏斗保持左、右两侧液面相平;
(4)小试管中产生的气体是氧气,根据氧气的量计算过氧化钙的量,从而计算其质量分数.
(2)依据装置中气体压强变化和液体液面变化分析判断气密性;
(3)液体能产生压强,如果左右两管中液体高度不同会对实验造成影响,所以读取量气管内液面的初、终读数前都需进行移动漏斗保持左、右两侧液面相平;
(4)小试管中产生的气体是氧气,根据氧气的量计算过氧化钙的量,从而计算其质量分数.
解答:解:(1)完全反应后的生成物中有可溶性的物质也有不溶性的物质,所以分离不溶性的固体和溶液的方法是过滤,滤液中含有氯化铵,从溶液中获得晶体应蒸发浓缩、冷却结晶、过滤等,
故答案为:过滤;蒸发浓缩,冷却结晶,过滤;
(2)依据装置压强变化和液面变化可知,连接好装置,从漏斗向量气筒内注入一定量的水,移动漏斗使左、右两侧形成液面高度差.静置后,液面高度不再变化,即表明气密性良好,
故答案为:连接好装置,从漏斗向量气筒内注入一定量的水,移动漏斗使左、右两侧形成液面高度差.静置后,液面高度不再变化,即表明气密性良好;
(3)移动漏斗保持液面与量气筒液面相平,防止试管和量气筒内气体压强过大造成误差,故答案为:移动漏斗保持左、右两侧液面相平;
(3)根据题意知,小试管中产生的气体是氧气,设过氧化钙的质量是x,
2CaO2
2CaO+O2↑
144g cL
x 10-3(b-a)L
x=0.144(b-a) c g
过氧化钙的质量分数=
×100%=
%,
故答案为:
%.
故答案为:过滤;蒸发浓缩,冷却结晶,过滤;
(2)依据装置压强变化和液面变化可知,连接好装置,从漏斗向量气筒内注入一定量的水,移动漏斗使左、右两侧形成液面高度差.静置后,液面高度不再变化,即表明气密性良好,
故答案为:连接好装置,从漏斗向量气筒内注入一定量的水,移动漏斗使左、右两侧形成液面高度差.静置后,液面高度不再变化,即表明气密性良好;
(3)移动漏斗保持液面与量气筒液面相平,防止试管和量气筒内气体压强过大造成误差,故答案为:移动漏斗保持左、右两侧液面相平;
(3)根据题意知,小试管中产生的气体是氧气,设过氧化钙的质量是x,
2CaO2
| ||
144g cL
x 10-3(b-a)L
x=0.144(b-a) c g
过氧化钙的质量分数=
| 0.144(b-a) |
| mc |
| 14.4(b-a) |
| mc |
故答案为:
| 14.4(b-a) |
| mc |
点评:本题考查了物质含量的测定实验,量气装置的使用原理,探究物质性质的实验设计和结果分析,难度中等.

练习册系列答案
 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案
相关题目
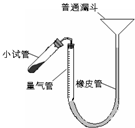
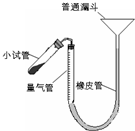 (2010?梅州一模)过氧化钙是重要的工业原料,350℃时能迅速分解,生成氧化钙,并放出氧气.工业上将碳酸钙溶于适量的盐酸中,在低温和碱性条件下,与过氧化氢反应制得:CaCO3+2HCl═CaCl2+CO2↑+H2O,CaCl2+H2O2+2NH3+8H2O═CaO2?8H2O↓+2NH4Cl.如图是实验室测定产品中过氧化钙含量的装置.试回答下列问题:
(2010?梅州一模)过氧化钙是重要的工业原料,350℃时能迅速分解,生成氧化钙,并放出氧气.工业上将碳酸钙溶于适量的盐酸中,在低温和碱性条件下,与过氧化氢反应制得:CaCO3+2HCl═CaCl2+CO2↑+H2O,CaCl2+H2O2+2NH3+8H2O═CaO2?8H2O↓+2NH4Cl.如图是实验室测定产品中过氧化钙含量的装置.试回答下列问题: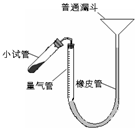 过氧化钙是重要的工业原料,350℃时能迅速分解,生成氧化钙,并放出氧气.工业上将碳酸钙溶于适量的盐酸中,在低温和碱性条件下,与过氧化氢反应制得:CaCO3+2HC1═CaCl2+CO2↑+H2O,CaC12+H2O2+2NH3+8H2O═CaO2?8H2O↓+2NH4Cl.如图是实验室测定产品中过氧化钙含量的装置.试回答下列问题:
过氧化钙是重要的工业原料,350℃时能迅速分解,生成氧化钙,并放出氧气.工业上将碳酸钙溶于适量的盐酸中,在低温和碱性条件下,与过氧化氢反应制得:CaCO3+2HC1═CaCl2+CO2↑+H2O,CaC12+H2O2+2NH3+8H2O═CaO2?8H2O↓+2NH4Cl.如图是实验室测定产品中过氧化钙含量的装置.试回答下列问题: