题目内容
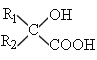
【题目】.二氧化氯是高效、低毒的消毒剂。已知:![]() 是一种黄绿色易溶于水的气体,具有强氧化性,回答下列问题:
是一种黄绿色易溶于水的气体,具有强氧化性,回答下列问题:
(1)![]() 的制备及性质探究装置如图:
的制备及性质探究装置如图:
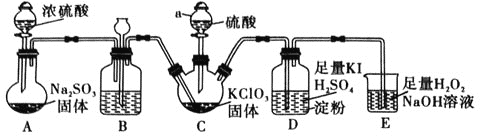
①仪器a的名称为________,装置B的作用是________。
②装置C用于制备![]() ,同时还生成一种酸式盐,该反应的化学方程式为________________。装置D的作用是________________。
,同时还生成一种酸式盐,该反应的化学方程式为________________。装置D的作用是________________。
③![]() 可用于处理碱性含硫废水
可用于处理碱性含硫废水![]() 硫被氧化为最高价态
硫被氧化为最高价态![]() ,
,![]() 与
与![]() 溶液反应的离子方程式为________________________。
溶液反应的离子方程式为________________________。
④装置E用于吸收尾气,反应可得![]() 溶液。已知
溶液。已知![]() 饱和溶液在温度低于
饱和溶液在温度低于![]() 时析出的晶体是
时析出的晶体是![]() ,在温度高于
,在温度高于![]() 时析出的晶体是
时析出的晶体是![]() 。请补充从
。请补充从![]() 溶液中制得
溶液中制得![]() 晶体的操作步骤:
晶体的操作步骤:
![]() ________________________;
________________________;
![]() ________________;
________________;
![]() 洗涤;
洗涤;
![]() 干燥。
干燥。
(2)测定生成![]() 的质量
的质量
实验步骤如下:
![]() 取下装置D,将其中的溶液转入250mL容量瓶,用蒸馏水洗涤装置
取下装置D,将其中的溶液转入250mL容量瓶,用蒸馏水洗涤装置![]() 次,并将洗涤液一并转移到容量瓶中,加蒸馏水稀释至刻度。
次,并将洗涤液一并转移到容量瓶中,加蒸馏水稀释至刻度。
![]() 从容量瓶中取出
从容量瓶中取出![]() 溶液于锥形瓶中,用
溶液于锥形瓶中,用![]() 硫代硫酸钠标准溶液滴定
硫代硫酸钠标准溶液滴定![]() ,指示剂显示终点时消耗硫代硫酸钠溶液
,指示剂显示终点时消耗硫代硫酸钠溶液![]() 。
。
![]() 滴定至终点的现象是________________________。
滴定至终点的现象是________________________。
![]() 进入装置D中的
进入装置D中的![]() 的质量为________________。
的质量为________________。
![]() 若滴定开始仰视读数,滴定终点时正确读数,则测定结果________
若滴定开始仰视读数,滴定终点时正确读数,则测定结果________![]() 填“偏高”“偏低”或“不变”
填“偏高”“偏低”或“不变”![]() 。
。
【答案】分液漏斗 安全瓶![]() 或防堵塞
或防堵塞![]()
![]() 检验有
检验有![]() 生成,进而证明
生成,进而证明![]() 具有强氧化性
具有强氧化性 ![]() 加热浓缩,冷却至
加热浓缩,冷却至![]() 以上结晶 趁热过滤 溶液由蓝色变为无色,且半分钟内不恢复原色
以上结晶 趁热过滤 溶液由蓝色变为无色,且半分钟内不恢复原色 ![]() 偏低
偏低
【解析】
(1)浓硫酸和亚硫酸钠反应生成二氧化硫, A制备二氧化硫, B装置有缓冲作用,能防止倒吸、堵塞;装置 C用于制备![]() ,同时还生成一种酸式盐,则 C中发生反应
,同时还生成一种酸式盐,则 C中发生反应![]() ,
,![]() 是一种黄绿色易溶于水的气体,具有强氧化性,所以 D中发生氧化还原反应生成碘,装置 D中滴有几滴淀粉溶液,碘遇淀粉变蓝色;装置 E用于吸收尾气,反应生成
是一种黄绿色易溶于水的气体,具有强氧化性,所以 D中发生氧化还原反应生成碘,装置 D中滴有几滴淀粉溶液,碘遇淀粉变蓝色;装置 E用于吸收尾气,反应生成![]() ,双氧水作还原剂生成氧气,从而防止尾气污染环境,据此分析解题;
,双氧水作还原剂生成氧气,从而防止尾气污染环境,据此分析解题;
(2)①淀粉遇碘变蓝,当终点时碘消耗完则蓝色消失;
②根据ClO2溶液与碘化钾反应的离子方程中计量关系进行计算解答;
③根据c待V待=c标V标,则c待=![]() 进行分析;
进行分析;
(1)![]() 仪器 a的名称为分液漏斗,装置 B有缓冲作用,所以能防倒吸、防堵塞
仪器 a的名称为分液漏斗,装置 B有缓冲作用,所以能防倒吸、防堵塞![]() 或平衡气压、安全瓶均可
或平衡气压、安全瓶均可![]() ;
;
![]() 装置 C用于制备
装置 C用于制备![]() ,同时还生成一种酸式盐,根据元素守恒知,生成的酸式盐为硫酸氢钠,该反应的化学方程式为
,同时还生成一种酸式盐,根据元素守恒知,生成的酸式盐为硫酸氢钠,该反应的化学方程式为![]() ;装置 D中滴有几滴淀粉溶液,淀粉遇碘变蓝色,根据淀粉是否变色来判断是否有碘生成,从而证明二氧化氯是否具有氧化性,
;装置 D中滴有几滴淀粉溶液,淀粉遇碘变蓝色,根据淀粉是否变色来判断是否有碘生成,从而证明二氧化氯是否具有氧化性,
![]() 与
与![]() 溶液反应的离子方程式为
溶液反应的离子方程式为![]() ;
;
![]() 装置 E用于吸收尾气,反应生成
装置 E用于吸收尾气,反应生成![]() ,从
,从![]() 溶液中制得
溶液中制得![]() 晶体的操作步骤:加热浓缩,冷却至
晶体的操作步骤:加热浓缩,冷却至![]() 以上结晶;趁热过滤;洗涤;干燥;
以上结晶;趁热过滤;洗涤;干燥;
(2)![]() 碘单质与淀粉变蓝色,所以滴定终点现象为溶液由蓝色变为无色,且半分钟内不恢复原色;
碘单质与淀粉变蓝色,所以滴定终点现象为溶液由蓝色变为无色,且半分钟内不恢复原色;
![]() ,
,![]() ,根据
,根据![]() ,
,![]() ,
,![]() ;
;
![]() 若滴定开始仰视读数,滴定终点时正确读数,则消耗标准液体积偏小,根据c待=
若滴定开始仰视读数,滴定终点时正确读数,则消耗标准液体积偏小,根据c待=![]() ,测定结果偏低。
,测定结果偏低。