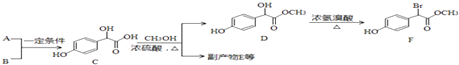
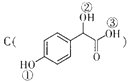
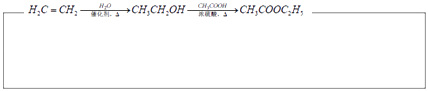
题目内容
【题目】有一澄清溶液其中可能含有NH4+、K+、Mg2+、Ba2+、Al3+、I﹣、NO3﹣、CO32﹣、SO42﹣中的几种,取该溶液进行以下实验:
(1)用pH试纸检验,表明溶液呈现强酸性,排除的存在.
(2)取出部分溶液,加入少量CCl4及数滴新制氯水,经振荡CCl4呈紫红色,生成该紫红色物质的离子方程式为 .
(3)另取部分溶液,逐渐向其中加入NaOH溶液,使溶液从酸性逐渐变为碱性,滴加过程中和滴加完毕后,均无沉淀产生,则可排除的存在.取部分碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝,则证明有存在.生成该气体的离子方程式为 .
(4)另取部分上述碱性溶液,向其中加入Na2CO3溶液,有白色沉淀生成,证明存在,又排除存在.
(5)综上所述,该溶液中上述离子尚不能确定是否存在的 .
(6)若要确认(5)中相关的离子,确认的实验方法是 .
【答案】
(1)CO32﹣
(2)Cl2+2I﹣=I2+2Cl﹣
(3)Mg2+、Al3+;NH4+;NH4++OH﹣ ![]() NH3↑+H2O
NH3↑+H2O
(4)Ba2+;SO42﹣
(5)K+
(6)焰色反应
【解析】解:(1)溶液为强酸性,则溶液中存在大量氢离子,CO32﹣能够与氢离子反应,所以原溶液中一定不存在CO32﹣ , 所以答案是:CO32﹣;(2)CCl4层呈紫红色,说明有I2 , 这是由于I﹣被氯气氧化生成碘单质,反应的离子方程式为:Cl2+2I﹣=I2+2Cl﹣ , 从而说明溶液中含有I﹣ , 而I﹣与Fe3+、NO3﹣和H+发生反应而不能共存,说明溶液中肯定不含有Fe3+、NO3﹣ ,
所以答案是:Cl2+2I﹣=I2+2Cl﹣;(3)溶液从酸性逐渐变为碱性,在滴加过程中和滴加完毕后,溶液均无沉淀产生,而Mg2+、Al3+能与碱反应产生沉淀,说明溶液中肯定不含有Mg2+、Al3+;产生的气体能使湿润的红色石蕊试纸变蓝,则该气体为氨气,说明溶液中肯定含NH4+ , 反应的离子方程式为:NH4++OH﹣ ![]() NH3↑+H2O,
NH3↑+H2O,
所以答案是:Mg2+、Al3+;NH4+;NH4++OH﹣ ![]() NH3↑+H2O;(4)取出部分上述碱性溶液加Na2CO3溶液后,有白色沉淀生成,说明溶液中肯定含有Ba2+ , 而Ba2+能与SO42﹣产生沉淀,说明溶液中不含SO42﹣ ,
NH3↑+H2O;(4)取出部分上述碱性溶液加Na2CO3溶液后,有白色沉淀生成,说明溶液中肯定含有Ba2+ , 而Ba2+能与SO42﹣产生沉淀,说明溶液中不含SO42﹣ ,
所以答案是:Ba2+;SO42﹣;(5)根据以上分析可知,无法确定原溶液中是否存在K+ ,
所以答案是:K+;(6)实验室中检验钠离子、钾离子时,通常采用焰色反应,注意观察钾离子的焰色反应火焰颜色时,需要通过蓝色的钴玻璃观察,
所以答案是:K+ .

 百年学典课时学练测系列答案
百年学典课时学练测系列答案 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案