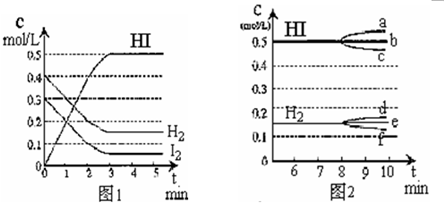
��Ŀ����
��ijһ�ݻ�Ϊ2L���ܱ������ڣ�����0.2mol��CO��0.2mol��H2O���ڴ������ڵ������¸��¼��ȣ��������·�Ӧ��
CO��g��+H2O��g��?CO2��g��+H2��g������H=a kJ/mol����Ӧ�ﵽƽ����c��CO����c��CO2��=3��2������˵����ȷ����
��������
CO��g��+H2O��g��?CO2��g��+H2��g������H=a kJ/mol����Ӧ�ﵽƽ����c��CO����c��CO2��=3��2������˵����ȷ����
��������
��������ﵽƽ��ʱ��COת��xmol����������ʽ�����㣬
CO��g��+H2O��g��?CO2��g��+H2��g��
��ʼ��0.2mol 0.2mol 0 0
ת����xmol xmol xmol xmol
ƽ�⣨0.2-x��mol ��0.2-x��mol xmol xmol
����0.2-x����x=3��2
x=0.08mol��
�Դ˽����⣮
CO��g��+H2O��g��?CO2��g��+H2��g��
��ʼ��0.2mol 0.2mol 0 0
ת����xmol xmol xmol xmol
ƽ�⣨0.2-x��mol ��0.2-x��mol xmol xmol
����0.2-x����x=3��2
x=0.08mol��
�Դ˽����⣮
����⣺��ﵽƽ��ʱ��COת��xmol����������ʽ�����㣬
CO��g��+H2O��g��?CO2��g��+H2��g��
��ʼ��0.2mol 0.2mol 0 0
ת����xmol xmol xmol xmol
ƽ�⣺��0.2-x��mol ��0.2-x��mol xmol xmol
����0.2-x����x=3��2
x=0.08mol��
A��ƽ��ʱH2O��ת����Ϊ
��100%=40%����A��ȷ��
B����Ӧ�ų�������Ϊ0.08akJ����B����
C���ж�ƽ��ı�־�����淴Ӧ������ͬ�����ɷ��ѶȲ��䣬����������Ũ����ͬ�أ���C����
D����Ӧǰ�������������䣬ѹǿ��ƽ���ƶ���Ӱ�죬��D����
��ѡ��A��
CO��g��+H2O��g��?CO2��g��+H2��g��
��ʼ��0.2mol 0.2mol 0 0
ת����xmol xmol xmol xmol
ƽ�⣺��0.2-x��mol ��0.2-x��mol xmol xmol
����0.2-x����x=3��2
x=0.08mol��
A��ƽ��ʱH2O��ת����Ϊ
| 0.08mol |
| 0.2mol |
B����Ӧ�ų�������Ϊ0.08akJ����B����
C���ж�ƽ��ı�־�����淴Ӧ������ͬ�����ɷ��ѶȲ��䣬����������Ũ����ͬ�أ���C����
D����Ӧǰ�������������䣬ѹǿ��ƽ���ƶ���Ӱ�죬��D����
��ѡ��A��
���������⿼�黯ѧƽ��ļ��㣬��Ŀ�Ѷ��еȣ������Ĺؼ��Ǹ���Ũ�ȹ�ϵ����ƽ��ʱ�����ʵ����ʵ�����ע����������ʽ�������Ϊֱ�ۣ�

��ϰ��ϵ�д�
�����Ŀ
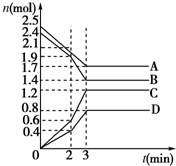 ��ijһ�ݻ�Ϊ2L���ܱ������У�A��B��C��D�������ʵ����ʵ���n��mol����ʱ��t��min���ı仯������ͼ��ʾ��
��ijһ�ݻ�Ϊ2L���ܱ������У�A��B��C��D�������ʵ����ʵ���n��mol����ʱ��t��min���ı仯������ͼ��ʾ��