题目内容
一混合气体,在密闭容器中发生如下反应:xA(g)+yB(g)?zC(g),达到平衡后,测得A的浓度为0.5mol/L,当在恒温下将密闭容器的容积扩大1倍再达平衡时,测得A的浓度为0.3mol/L.则下列叙述正确的是( )
分析:保持温度不变,将容器的体积扩大1倍,如平衡不移动,A的浓度为0.25mol/L,小于实际A的浓度变为0.3mol/L,说明平衡向生成A的方向移动,即向逆反应移动,据此结合选项解答.
解答:解:保持温度不变,将容器的体积扩大两倍,如平衡不移动,A的浓度为0.25mol/L,小于实际A的浓度变为0.3mol/L,说明平衡向生成A的方向移动,即向逆反应移动,
A、增大体积,压强减小,平衡向逆反应移动,压强减小平衡向气体物质的量增大的方向移动,即x+y>z,故A正确;
B、依据分析判断,化学平衡逆向进行,故B错误;
C、平衡向逆反应方向移动,B的转化率降低,故C错误;
D、平衡向逆反应移动,减小压强平衡向气体物质的量增大的方向移动,气体A的物质的量增大,故D错误;
故选:A.
A、增大体积,压强减小,平衡向逆反应移动,压强减小平衡向气体物质的量增大的方向移动,即x+y>z,故A正确;
B、依据分析判断,化学平衡逆向进行,故B错误;
C、平衡向逆反应方向移动,B的转化率降低,故C错误;
D、平衡向逆反应移动,减小压强平衡向气体物质的量增大的方向移动,气体A的物质的量增大,故D错误;
故选:A.
点评:本题考查化学平衡移动,难度中等,利用假设法判断平衡移动方向是解题关键.

练习册系列答案
相关题目
 HCO3-+OH-
HCO3-+OH-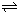 C2D4(g);△H<0.在恒温恒容条件下,将一定量CD2和C2D4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如图所示.
C2D4(g);△H<0.在恒温恒容条件下,将一定量CD2和C2D4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如图所示.