题目内容
8.从2L1mol/L NaOH溶液中取出100mL,下列关于这100mL溶液的叙述错误的是( )| A. | 浓度为0.1mol/L | B. | 浓度为1mol/L | C. | 含NaOH 4g | D. | 含NaOH 0.1mol |
分析 由于溶液是均匀的,从2L 1mol/L NaOH溶液中取出100ml溶液,这100ml氢氧化钠溶液与剩余的900mL氢氧化钠溶液的浓度相同,与原2L 1mol/L NaOH溶液浓度相同.
A、由于溶液是均匀的,取出的100ml氢氧化钠溶液与原1L 1mol/L NaOH溶液浓度相同;
B、由于溶液是均匀的,取出的100ml氢氧化钠溶液与原1L 1mol/L NaOH溶液浓度相同;
C、根据m=cVM计算100ml溶液中氢氧化钠的质量.
D、根据n=cV计算100ml溶液中氢氧化钠的物质的量.
解答 解:由于溶液是均匀的,从2L 1mol/L NaOH溶液中取出100ml溶液,这100ml氢氧化钠溶液与原2L 1mol/L NaOH溶液浓度相同为1mol/L.
A、由于溶液是均匀的,取出的100ml氢氧化钠溶液与原2L 1mol/L NaOH溶液浓度相同为1mol/L,故A错误;
B、由于溶液是均匀的,取出的100ml氢氧化钠溶液与原1L 1mol/L NaOH溶液浓度相同为1mol/L,故B正确;
C、取出的100ml氢氧化钠溶液中氢氧化钠的质量为0.1L×1mol/L×40g/mol=4g,故C正确;
D、取出的100ml氢氧化钠溶液中氢氧化钠的物质的量为0.1L×1mol/L=0.1mol,故D正确;
故选A.
点评 本题考查学生对物质的量浓度的理解与常用化学计量的有关计算,比较基础,注意基础知识的理解掌握,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
19.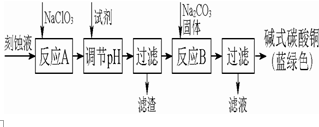 碱式碳酸铜是一种用途广泛的化工原料.工业上可用酸性刻蚀废液(主要成分有Cu2+、Fe2+、Fe3+、H +、Cl-)制备,其制备过程如图图所示.Cu2+、Fe2+、Fe3+生成沉淀的pH如表格所示:
碱式碳酸铜是一种用途广泛的化工原料.工业上可用酸性刻蚀废液(主要成分有Cu2+、Fe2+、Fe3+、H +、Cl-)制备,其制备过程如图图所示.Cu2+、Fe2+、Fe3+生成沉淀的pH如表格所示:
(1)氯酸钠的作用是将Fe2+氧化成Fe3+并最终除去;滤渣的主要成分是Fe(OH)3(写化学式).
(2)反应A后调节溶液的pH范围应为3.2-4.2.可以选择的试剂是bd(填序号).
a.氨水 b.氧化铜 c.氧化镁 d.碳酸铜 e..稀氢氧化钠
(3)反应B的温度若过高,则所得蓝绿色产品中可能会出现的杂质是CuO.(写化学式)
(4)洗涤过滤得到的产品时,如何判断产品已经洗净?取最后一次洗涤液,加入硝酸银和稀硝酸,无沉淀生成则表明已洗涤干净.
(5)将Na2CO3溶液滴入到一定量CuCl2溶液中得到沉淀.
①若沉淀只有CuCO3,则相应的离子方程式为Cu2++CO32-=CuCO3↓.
②若沉淀只有Cu(OH)2,用相应的离子方程式表示其过程:Cu2++CO32-+H2O=Cu(OH)2↓+CO2↑.
 碱式碳酸铜是一种用途广泛的化工原料.工业上可用酸性刻蚀废液(主要成分有Cu2+、Fe2+、Fe3+、H +、Cl-)制备,其制备过程如图图所示.Cu2+、Fe2+、Fe3+生成沉淀的pH如表格所示:
碱式碳酸铜是一种用途广泛的化工原料.工业上可用酸性刻蚀废液(主要成分有Cu2+、Fe2+、Fe3+、H +、Cl-)制备,其制备过程如图图所示.Cu2+、Fe2+、Fe3+生成沉淀的pH如表格所示:| 物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 4.2 | 5.8 | 1.2 |
| 完全沉淀pH | 6.7 | 8.3 | 3.2 |
(2)反应A后调节溶液的pH范围应为3.2-4.2.可以选择的试剂是bd(填序号).
a.氨水 b.氧化铜 c.氧化镁 d.碳酸铜 e..稀氢氧化钠
(3)反应B的温度若过高,则所得蓝绿色产品中可能会出现的杂质是CuO.(写化学式)
(4)洗涤过滤得到的产品时,如何判断产品已经洗净?取最后一次洗涤液,加入硝酸银和稀硝酸,无沉淀生成则表明已洗涤干净.
(5)将Na2CO3溶液滴入到一定量CuCl2溶液中得到沉淀.
①若沉淀只有CuCO3,则相应的离子方程式为Cu2++CO32-=CuCO3↓.
②若沉淀只有Cu(OH)2,用相应的离子方程式表示其过程:Cu2++CO32-+H2O=Cu(OH)2↓+CO2↑.
16.下列实验方案中,可行的是( )
| A. | 用加入适量NaCl溶液的方法除去Cu(NO3)2溶液中的AgNO3杂质 | |
| B. | 用洗气瓶中的NaOH溶液除去CO2气体中混有的HCl气体 | |
| C. | 分离FeCl3、KCl、BaSO4的固体混合物,应采用的一组试剂是:水、氢氧化钠、盐酸 | |
| D. | 先后添加石蕊试液、BaCl2溶液,将盐酸、硫酸、硫酸钠、氢氧化钠和硝酸钾五种无色溶液鉴别开. |
3.据统计,机动车保有量每年以15%至20%的速度增长,交通事故也频发;汽车在剧烈碰撞时,安全气囊中发生反应10NaN3+2KNO3═K2O+5Na2O+16N2↑.则下列判断正确的是( )
| A. | 还原剂与氧化产物的物质的量之比为5:8 | |
| B. | 若氧化产物比还原产物多1.4mol则转移电子为1mol | |
| C. | 每生成1.6mol氮气,则有0.2molKNO3被氧化 | |
| D. | NaN3属于硝酸盐 |
13.配制一定物质的量浓度的溶液不需要用到的仪器是( )
| A. |  | B. |  | C. |  | D. |  |
20.下列说法不正确的是( )
| A. | 钢是铁合金,钢的含碳量低于生铁,性能优于生铁 | |
| B. | 金属具有的物理通性是延展性、导热性、银白色光泽、导电性 | |
| C. | 符号Al既能表示铝元素,又能表示一个铝原子,还能表示铝单质 | |
| D. | 焊锡是锡铅合金,把铅加入锡中制成合金的主要目的是降低熔点 |
17.下列说法正确的是( )
| A. | 120℃,将wg甲醛在足量空气中燃烧,将生成产物用固体Na2O2(过量)吸收,固体增重wg | |
| B. | 24gMg带在足量CO2气体中燃烧,生成固体质量为40g | |
| C. | 相同物质的量的Al、Al2O3、Al(OH)3与足量NaOH溶液反应,溶液增重相等 | |
| D. | 在Fe3O4与足量浓硝酸的反应中,参加反应的Fe3O4与体现酸性的HNO3物质的量之比为1:10 |

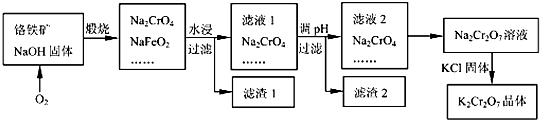
 Cr2O72-+H2O的存在,加稀硫酸增大了H+的浓度,平衡正向移动,使CrO42-浓度减小,Cr2O72-浓度增大,溶液由黄色变为橙色.
Cr2O72-+H2O的存在,加稀硫酸增大了H+的浓度,平衡正向移动,使CrO42-浓度减小,Cr2O72-浓度增大,溶液由黄色变为橙色.