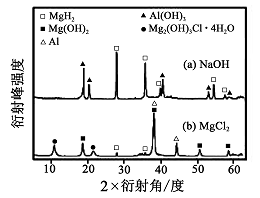
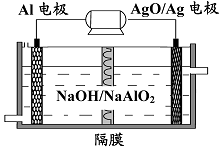
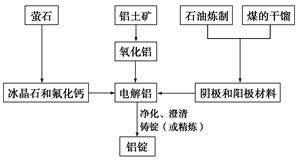
题目内容
硫酸亚铁铵【(NH4)2Fe(SO4)2】俗称莫尔盐,工业上用途广泛,该物质属于 。
A、酸 B、碱 C、盐
某同学为了验证硫酸亚铁铵晶体中的阳离子,进行了如下操作。
(1)室温下,将少量的硫酸亚铁铵晶体配成溶液,并将所配溶液分置于两支试管中,用其中一支进行验证Fe2+的实验,请完成下表:
| 操作 | ①往试管中滴入几滴 溶液(填化学式) | ②继续滴入几滴新制氯水 |
| 现象 | 溶液无明显变化 | 溶液显红色 |
| 原因 | 溶液中没有Fe3+ | (用简要文字说明原因) |
(2)为了验证NH4+该同学往另一支试管中滴加过量的浓氢氧化钠溶液并加热,并在试管口用湿润的红色石蕊试纸检验反应产物,红色石蕊试纸变蓝,同时试管内有红褐色固体产生,则加热时试管内反应的离子方程式是 。
C (1)操作 ①KSCN 原因氯气有氧化性,将亚铁离子氧化为铁离子。铁离子遇到KSCN溶液显红色。(2)8NH4++4Fe2++16OH-+O2 4Fe(OH)3↓+8NH3↑+6H2O
4Fe(OH)3↓+8NH3↑+6H2O
解析试题分析:Fe3+的水溶液遇到SCN-时会变为红色,Fe2+遇到SCN-不变色。在实验室中常利用这一特性来检验。Fe3+的存在。但是Fe2+有强的还原性,当它和强氧化剂如氯气、过氧化氢、重铬酸钾等物质时会被氧化为Fe3+.这时就会和SCN-发生反应,溶液变为血红色。如果溶液中含有铵根离子,遇到热的碱溶液时发生反应:NH4++OH- NH3↑+H2O. 氨气的水溶液显碱性能使湿润的红色石蕊试纸变蓝色。根据硫酸亚铁铵溶液中滴加过量的浓氢氧化钠溶液并加热,并在试管口用湿润的红色石蕊试纸检验反应产物,红色石蕊试纸变蓝,同时试管内有红褐色固体产生,可知反应产物除了氨气还有氢氧化铁沉淀。结合质量守恒定律,产物还应该有水。反应的化学方程式为:8NH4++4Fe2++16OH-+O2
NH3↑+H2O. 氨气的水溶液显碱性能使湿润的红色石蕊试纸变蓝色。根据硫酸亚铁铵溶液中滴加过量的浓氢氧化钠溶液并加热,并在试管口用湿润的红色石蕊试纸检验反应产物,红色石蕊试纸变蓝,同时试管内有红褐色固体产生,可知反应产物除了氨气还有氢氧化铁沉淀。结合质量守恒定律,产物还应该有水。反应的化学方程式为:8NH4++4Fe2++16OH-+O2 4Fe(OH)3↓+8NH3↑+6H2O
4Fe(OH)3↓+8NH3↑+6H2O
考点:考查NH4+、Fe3+、Fe2+的检验及Fe3+和Fe2+的相互转化的知识。

 阶梯计算系列答案
阶梯计算系列答案在实验室里,某同学取一小块金属钠做钠与水反应的实验。试完成下列问题:
(1)切开的金属钠暴露在空气中,最先观察到的现象是____________________________,所发生反应的化学方程式是_______________________________________________。
(2)将钠投入水中后,钠熔化成一个小球,根据这一现象你能得出的结论是
①_______________________________________________,
②_______________________________________________。
将一小块钠投入盛有饱和石灰水的烧杯中,不可能观察到的现象是________。
| A.有气体生成 |
| B.钠熔化成小球并在液面上游动 |
| C.烧杯底部有银白色的金属钙生成 |
| D.溶液变浑浊 |
 6Cu+SO2
6Cu+SO2 2CuO,CuO+H2SO4=CuSO4+H2O
2CuO,CuO+H2SO4=CuSO4+H2O
 ,该反应的还原剂是__________。当有1mol MoS2反应时,还原剂失去电子的物质的量为________。
,该反应的还原剂是__________。当有1mol MoS2反应时,还原剂失去电子的物质的量为________。
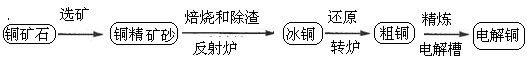
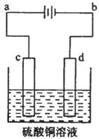
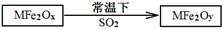
 2Cu+SO2反应制取粗铜,当有32gCu2S消耗时,电子转移数目是 。
2Cu+SO2反应制取粗铜,当有32gCu2S消耗时,电子转移数目是 。