题目内容
(1)铜是人类最早使用的金属之一,以下是冶炼铜的一个反应:
Cu2S+2Cu2O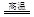 6Cu+SO2
6Cu+SO2
该反应中被氧化的元素是 ,若反应中转移1mol电子,得到Cu mol。
(2)下列两种方法均可以制备CuSO4。
方法一:2Cu+O2 2CuO,CuO+H2SO4=CuSO4+H2O
2CuO,CuO+H2SO4=CuSO4+H2O
方法二:Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
①假如某工厂欲生产CuSO4,请选择一种方法,并说明理由:
。
②有同学认为,生成等量的硫酸铜两种方法消耗的能量相同,因为反应都是铜转变为CuSO4,你认为上述说法 (填“正确”或“不正确”),原因是
。
(1)S(或硫)(1分) 1 (1分)
(2)①方法一(1分),硫酸原料利用率高,对环境污染小(1分)
②不正确 (1分) 反应物与产物不完全相同,故反应的热效应不同,消耗的能量也不同(2分)
解析试题分析:(1)化合价升高的元素是S,化合价降低的只有Cu 且Cu从+1价到0价,故转移1mole-时得到1molCu
(2)①由方程式可知生成等量的CuSO4需硫酸的量方法一少,且方法一无污染。故答案为:方法一,硫酸原料利用率高,对环境污染小。
②因反应中反应物与产物不完全相同,故反应的热效应不同,消耗的能量也不同,故不正确
考点:考查氧化还原反应、计算、工业生产等相关知识。

 科学实验活动册系列答案
科学实验活动册系列答案硫酸亚铁铵【(NH4)2Fe(SO4)2】俗称莫尔盐,工业上用途广泛,该物质属于 。
A、酸 B、碱 C、盐
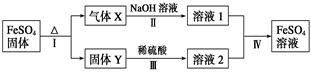
某同学为了验证硫酸亚铁铵晶体中的阳离子,进行了如下操作。
(1)室温下,将少量的硫酸亚铁铵晶体配成溶液,并将所配溶液分置于两支试管中,用其中一支进行验证Fe2+的实验,请完成下表:
| 操作 | ①往试管中滴入几滴 溶液(填化学式) | ②继续滴入几滴新制氯水 |
| 现象 | 溶液无明显变化 | 溶液显红色 |
| 原因 | 溶液中没有Fe3+ | (用简要文字说明原因) |
(2)为了验证NH4+该同学往另一支试管中滴加过量的浓氢氧化钠溶液并加热,并在试管口用湿润的红色石蕊试纸检验反应产物,红色石蕊试纸变蓝,同时试管内有红褐色固体产生,则加热时试管内反应的离子方程式是 。
 2SO3(g),该反应的平衡常数表达式为K= ; 工业在接触法制硫酸的生产中,采取下列哪些措施有利于提高SO2转化率 。
2SO3(g),该反应的平衡常数表达式为K= ; 工业在接触法制硫酸的生产中,采取下列哪些措施有利于提高SO2转化率 。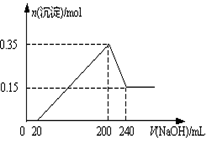
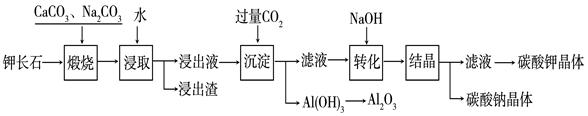
 Al(OH)3 + OH— ,“浸取”时应保持溶液呈 性(填“酸”或“碱”)。
Al(OH)3 + OH— ,“浸取”时应保持溶液呈 性(填“酸”或“碱”)。