题目内容
在一个U形管里盛有氯化铜溶液,并插入两块纯锌片作电极,如右图:

(1)如果把电键K接A,这一装置形成_________装置,Zn①极是________极,其电极反应式是_________;
Zn②极上的电极反应式是____________________。
(2)上述反应进行5min后,转换电键K到C,这一装置形成____________装置,Zn①极是__________极,该装置发生反应的总化学方程式是___________________________;

(1)如果把电键K接A,这一装置形成_________装置,Zn①极是________极,其电极反应式是_________;
Zn②极上的电极反应式是____________________。
(2)上述反应进行5min后,转换电键K到C,这一装置形成____________装置,Zn①极是__________极,该装置发生反应的总化学方程式是___________________________;
(8分)(每空1分,最后一空2分)
(1)电解池;阳极 ; Zn-2e-= Zn2+; Cu2++2e-= Cu。
(2)原电池;负极; Zn+CuCl2= ZnCl2+Cu。
(1)电解池;阳极 ; Zn-2e-= Zn2+; Cu2++2e-= Cu。
(2)原电池;负极; Zn+CuCl2= ZnCl2+Cu。
试题分析:(1)如果把电键K接A,有外接电源,是电解池,和电源的正极相连的Zn①极是阳极,发生的电极反应为:
Zn═Zn2++2e-,故答案为:电解池;阳;Zn═Zn2++2e-;
(2)转换电键K到C,没有外接电源,是原电池,Zn①极失电子,所以为负极,Zn②极为正极,发生得电子的还原反应,电极反应为:Cu2++2e-→Cu,故答案为:原电池;正;Cu2++2e-═Cu;
(3)进行2min后,再转换电键K到B,Zn①极发生的反应为:Zn+CuCl2═Cu+ZnCl2,Zn②极上析出了铜,形成原电池,发生的电极反应为:负极:Zn-2e-→Zn2+,正极:Cu2++2e-═Cu。
故在Zn②极上发生的腐蚀属于电化学腐蚀,Zn①极发生的腐蚀主要属于化学腐蚀,故答案为:电化学腐蚀;化学腐蚀。
点评:本题考查学生原电池和电解池的工作原理知识,考查学生分析和解决问题的能力,难度较大。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目


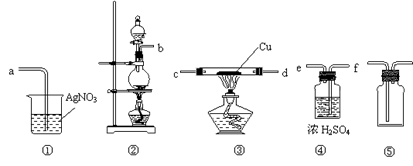
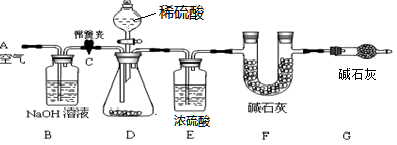
 ,以证明最终通入AgNO3溶液中的气体只有一种。你认为装置
,以证明最终通入AgNO3溶液中的气体只有一种。你认为装置