题目内容
下列各表述与示意图一致的是( )
A、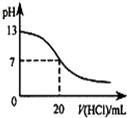 如图表示25℃时,用0.1mol?L-1盐酸滴定20mL 0.1mol?L-1 NaOH溶液,溶液的pH随加入酸体积的变化 |
B、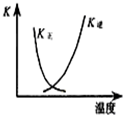 图中曲线表示反应2SO2(g)+O2(g)?2SO3(g)△H<0,正、逆反应的平衡常数K随温度的变化 |
C、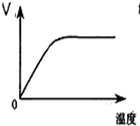 如图表示淀粉在淀粉酶作用下水解速率随温度的变化 |
D、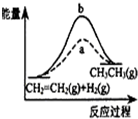 图中a、b曲线分别表示反应CH2=CH2(g)+H2(g)→CH3CH3(g)△H<0使用(a)和未使用(b)催化剂时,反应过程中的能量变化 |
考点:酸碱混合时的定性判断及有关ph的计算,化学反应速率的影响因素,化学平衡的影响因素
专题:图示题
分析:A.在滴入20mL氯化氢时,氢氧化钠就与氯化氢恰好反应,滴定曲线应该有一个滴定突变;
B.正逆反应的平衡常数互为倒数关系;
C.淀粉酶的催化活性有最佳温度,温度过高后淀粉蛋白酶会变性,失去生理活性,即失去催化效果;
D.该反应为放热反应,反应物总能量应该高于生成物总能量.
B.正逆反应的平衡常数互为倒数关系;
C.淀粉酶的催化活性有最佳温度,温度过高后淀粉蛋白酶会变性,失去生理活性,即失去催化效果;
D.该反应为放热反应,反应物总能量应该高于生成物总能量.
解答:
解:A.0.1mol?L-1NaOH溶液的pH为13,用0.1mol?L-1盐酸滴定恰好中和时pH为7,因浓度相同,则体积相同,但酸碱中和在接近终点时,pH会发生突变,曲线的斜率会很大,故A错误;
B.因反应为放热反应,则升高温度,平衡逆向移动,平衡后升温K逆减小,而K正增大,且正逆反应的平衡常数互为倒数关系,故B正确;
C.淀粉蛋白酶为蛋白质,其催化活性有最佳温度,当温度较高是,蛋白酶会发生变性,失去了催化效果,反应速率将减小,图象与实际不相符,故C错误;
D.因该反应是放热反应,应反应物的总能量大于生成物的总能量,但图象描述是反应物总能量低于生成物总能量,反应为吸热反应,故D错误;
故选B.
B.因反应为放热反应,则升高温度,平衡逆向移动,平衡后升温K逆减小,而K正增大,且正逆反应的平衡常数互为倒数关系,故B正确;
C.淀粉蛋白酶为蛋白质,其催化活性有最佳温度,当温度较高是,蛋白酶会发生变性,失去了催化效果,反应速率将减小,图象与实际不相符,故C错误;
D.因该反应是放热反应,应反应物的总能量大于生成物的总能量,但图象描述是反应物总能量低于生成物总能量,反应为吸热反应,故D错误;
故选B.
点评:本题以图象的形式考查学生中和滴定、化学平衡、淀粉蛋白酶的催化活性与温度的关系、反应中的能量变化等知识,这些知识点是新课程改革考查的重点,明确考点“形变神不变”,试题培养了学生的分析、理解能力及灵活应用所学知识的能力.

练习册系列答案
 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案
相关题目
如图是化学实验常用装置之一,若气体从右管进入,可用来收集的气体是( )
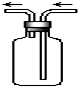

| A、NO |
| B、NO2 |
| C、NH3 |
| D、SO2 |
下列各组物质不属于同分异构体的是( )
| A、1,3-丁二烯和环丁烷 |
| B、邻氯甲苯和对氯甲苯 |
| C、2-甲基丁烷和戊烷 |
| D、2,2-二甲基丙醇和2-甲基丁醇 |
下列实验操作正确的是( )
A、 |
B、 |
C、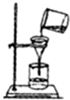 |
D、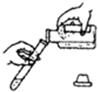 |
已知1~18号元素的离子aW3+、bX+、cY2-、dZ-都具有相同的电子层结构,下列关系正确的是( )
| A、质子数c>b |
| B、离子的还原性Y2->Z- |
| C、氢化物的稳定性H2Y>HZ |
| D、原子半径X<W |
某有机物的分子式是C3H4O2,它的水溶液显酸性,能跟Na2CO3溶液反应,又能使溴水褪色,则该有机物可能发生的反应有( )
①加成反应 ②取代反应 ③酯化反应 ④中和反应 ⑤氧化反应 ⑥加聚反应.
①加成反应 ②取代反应 ③酯化反应 ④中和反应 ⑤氧化反应 ⑥加聚反应.
| A、②③④⑥ | B、③④⑤⑥ |
| C、①②③④⑤⑥ | D、①②④⑤ |
下列操作中不正确的是( )
| A、铁粉中混有铝粉:加入过量烧碱溶液充分反应、过滤 |
| B、检验SO2中是否含CO2:先通入到饱和NaHCO3溶液中除SO2,再通入到澄清石灰水中 |
| C、NaHCO3溶液中混有少量Na2CO3:往该溶液中通入过量CO2气体 |
| D、NaCl溶液中混有少量I2:加入适量CCl4,振荡,静置,分液 |