题目内容
某同学查阅教材得知,普通锌锰电池筒内无机物质主要成分为MnO2、NH4Cl、ZnCl2等物质.他在探究废干电池内的黑色固体回收利用时,进行如图所示实验:
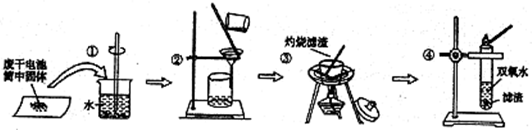
下列有关实验的叙述中,不正确的是
- A.操作①中玻璃棒的作用是加快固体溶解速度
- B.操作②的操作名称是过滤
- C.操作③中盛放药品的仪器是坩埚
- D.操作④的目的是除去滤渣中杂质
- E.操作④的目的是除去滤渣中杂质
分析:A.根据玻璃棒的作用判断;
B.操作②是把固体与溶液分离;
C.由图可知操作③是在坩埚内灼烧滤渣;
D.二氧化锰是黑色固体,能作双氧水的催化剂,操作④的目的不是除去滤渣中杂质;
解答:A.操作①中玻璃棒起到搅拌加速溶解的作用,故A正确;
B.普通锌锰电池筒内无机物质主要成分为MnO2、NH4Cl、ZnCl2等物质,NH4Cl、ZnCl2易溶于水,MnO2难溶于水,操作②是把固体与溶液分离,应是过滤,故B正确;
C.由图可知操作③是在坩埚内灼烧滤渣,通常把泥三角放在三角架上,再把坩埚放在泥三角上,故C正确;D.二氧化锰是黑色固体,能作双氧水的催化剂,灼烧后的滤渣能加快双氧水分解产生氧气,能证明黑色固体是二氧化锰,所以该实验的目的不是除去滤渣中杂质,故D错误;
故选D.
点评:本题以对干电池物质成分的探究为载体,考查了过滤、仪器名称、物质的检验等知识,掌握实验基本操作是解答关键,题目难度不大.

 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案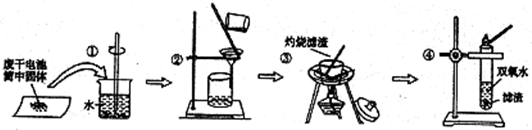
下列有关实验的叙述中,不正确的是( )
| A、操作①中玻璃棒的作用是加快固体溶解速度 | B、操作②的操作名称是过滤 | C、操作③中盛放药品的仪器是坩埚 | D、操作④的目的是除去滤渣中杂质 | E、操作④的目的是除去滤渣中杂质 |
(1)在干净试管中加入2ml 2%
(2)依次滴加2%、5%、10%、20%、40%的乙醛溶液4滴,快速振荡后置于60℃~70℃的水浴中.3分钟后,试管1#未形成大面积银镜,试管5#的银镜质量差有黑斑,试管4#产生的银镜质量一般,试管2#、3#形成光亮的银镜.该研究的目的是:
(3)乙醛发生银镜反应的化学方程式为:
(4)有文献记载:在强碱性条件下,加热银氨溶液可能析出银镜.验证和对比实验如下.
| 装置 | 实验序号 | 试管中的药品 | 现象 |
 |
实验Ⅰ | 2mL银氨溶液和数滴较浓NaOH溶液 | 有气泡产生: 一段时间后,溶液逐渐变黑:试管壁附着银镜 |
| 实验Ⅱ | 2mL银氨溶液和 数滴浓氨水 |
有气泡产生:一段时间后,溶液无明显变化 |
a.Ag(NH3)2++2H2O?Ag++2NH3?H2O b.AgOH不稳定,极易分解为黑色Ag2O
经检验,实验Ⅰ的气体中有NH3,黑色物质中有Ag2O.产生Ag2O的原因是:
(5)用湿润的红色石蕊试纸检验NH3产生的现象是
(6)该同学对产生银镜的原因提出假设:在NaOH存在下,可能是NH3还原Ag2O.如果该假设成立,则说明检验醛基时,银氨溶液不能呈强碱性,因为:
银镜反应是检验醛基的重要反应,教材对该实验的操作条件只是粗略的描述。某同学进行如下研究:
(1)在干净试管中加入2ml2% ,然后, 得到银氨溶液,分装入5支试管,编号为1#.2#.3#.4#.5# 。
(2)依次滴加2%.5%.10%.20%.40%的乙醛溶液4滴,快速振荡后置于60℃~70℃的水浴中。3分钟后,试管1#未形成大面积银镜,试管5# 的银镜质量差有黑斑, 试管4# 产生的银镜质量一般,试管2#.3# 形成光亮的银镜。
该研究的目的是: 。
(3)乙醛发生银镜反应的化学方程式为: ,
(4)有文献记载:在强碱性条件下,加热银氨溶液可能析出银镜。验证和对比实验如下。
|
装置 |
实验序号 |
试管中的药品 |
现象 |
|
|
实验Ⅰ |
2mL银氨溶液和数滴较浓NaOH溶液 |
有气泡产生: 一段时间后,溶液逐渐变黑:试管壁附着银镜 |
|
实验Ⅱ |
2mL银氨溶液和 数滴浓氨水 |
有气泡产生:一段时间后,溶液无明显变化 |
该同学欲分析实验Ⅰ和实验Ⅱ的差异,查阅资料后,得知:
a.Ag(NH3)2++2H2O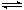 Ag++2NH3·H2O b.AgOH不稳定,极易分解为黑色Ag2O
Ag++2NH3·H2O b.AgOH不稳定,极易分解为黑色Ag2O
经检验,实验Ⅰ的气体中有NH3,黑色物质中有Ag2O。产生Ag2O的原因是:
。
(5)用湿润的红色石蕊试纸检验NH3产生的现象是 。用稀HNO3清 洗试管壁上的Ag,该反应的化学方程式是 。
(6)该同学对产生银镜的原因提出假设:在NaOH存在下,可能是NH3还原Ag2O。如果该假设成立,则说明检验醛基时,银氨溶液不能呈强碱性,因为:
高一新教材中有一演示实验,用脱脂棉包住约0.2g过氧化钠粉末,置于石棉网上,往脱脂棉上滴水,观察到脱脂棉剧烈燃烧起来。
(1)由上述实验现象所得出的有关过氧化钠跟水反应的结论是:
第一,有氧气生成,第二, 。Na2O2跟水反应的化学方程式是 ,
其中还原剂是 ,氧化剂是 。
(2)某研究性学习小组拟用A图所示装置(气密性良好)进行实验,以证明上述结论。用以验证第一条结论的实验方法是:
用以验证第二条结论的实验方法是:
(3)实验(2)往试管中加水至固体完全溶解且不再有气泡生成后,取出试管,往试管中滴入酚酞试液,发现溶液先变红后褪色。为探究其原因,该小组同学从查阅有关资料中得知:Na2O2与水反应可生成H2O2,H2O2具有强氧化性和漂白性。请设计一个简单的实验,验证Na2O2跟足量水充分反应后的溶液中有H2O2存在。(只要求写出实验所用的试剂及观察到的现象)
试剂: 。
现象: 。
(4)该小组同学提出用定量的方法探究Na2O2跟水反应后的溶液中否含有H2O2,其实验方法为:称取2.6g Na2O2固体,使之与足量的水反应,测量产生O2的体积并与理论值比较,即可得出结论。
|
①测量气体体积时,必须待试管和量筒内的气体都冷却至室温时进行,应选用上图装置中的(忽略导管在量筒中所占的体积) (填序号),理由是 。
②若在标准状况下测量气体的体积,应选用的量筒的大小规格为
(选填“100mL”“200mL”“500mL”或“1000mL”)。

