题目内容
2.丙烷在燃烧时能放出大量的热,它也是液化石油气的主要成分,作为能源应用于人们的日常生产和生活.已知:①2C3H8(g)+7O2(g)═6CO(g)+8H2O (l)△H1=-2741.8kJ/mol
②2CO (g)+O2(g)═2CO2(g)△H2=-566kJ/mol
(1)反应C3H8(g)+5O2(g)═3CO2(g)+4H2O(l) 的△H=-2219.9kJ/mol
(2)现有1mol C3H8在不足量的氧气里燃烧,生成1mol CO和2mol CO2以及气态水,将所有的产物通入一个固定体积为1L的密闭容器中,在一定条件下发生如下可逆反应:
CO(g)+H2O(g)?CO2(g)+H2(g)△H=+41.2kJ/mol
①下列事实能说明该反应达到平衡的是bd
a.体系中的压强不发生变化 b.V正(H2)=V 逆(CO)
c.混合气体的平均相对分子质量不发生变化 d.CO2的浓度不再发生变化
②5min后体系达到平衡,经测定,H2为0.8mol,则v(H2O)=0.16mol/(L.min);此时该反应的平衡常数K为3.5
③向平衡体系中充入少量CO则平衡常数K不变(填“增大”、“减小”或“不变”)
(3)依据(1)中的反应可以设计一种新型燃料电池,一极通入空气,另一极通入丙烷气体;燃料电池内部是熔融的掺杂着氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在其内部可以传导O2-,电池内部O2-由正极移向负极(填“正”或“负”);电池的负极电极反应式为C3H8+10O2--20e-═3CO2+4H2O
(4)用上述燃料电池和惰性电极电解足量Mg(NO3)2和NaCl的混合溶液.电解开始后阴极区的现象为有无色气体生成,有白色沉淀生成.
分析 (1)①2C3H8(g)+7O2(g)═6CO(g)+8H2O (l)△H1=-2741.8kJ/mol
②2CO (g)+O2(g)═2CO2(g)△H2=-566kJ/mol
将方程式$\frac{①+3②}{2}$得反应方程式C3H8(g)+5O2(g)═3CO2(g)+4H2O(l),
焓变进行相应的改变;
(2)①可逆反应达到平衡状态时,正逆反应速率相等,且反应体系中各物质的物质的量不变、物质的量浓度不变、百分含量不变以及由此引起的一系列物理量不变;
②先计算氢气的反应速率,再根据同一反应方程式中同一时间段内各物质的反应速率之比等于其计量数之比计算水蒸气反应速率;
根据H原子守恒知,生成n(H2O)=4n(C3H8)=4mol,
CO(g)+H2O(g)?CO2(g)+H2(g)
开始(mol/L)1 4 2 0
反应(mol/L)0.8 0.8 0.8 0.8
平衡(mol/L)0.2 3.2 2.8 0.8
化学平衡常数K=$\frac{c(C{O}_{2}).c({H}_{2})}{c(CO).c({H}_{2}O)}$;
③化学平衡常数只与温度有关,温度相等其化学平衡常数相等;
(3)原电池中阴离子向负极移动、阳离子向正极移动,所有的燃料电池中,负极上通入燃料、正极上通入氧化剂,该燃料电池中,负极上丙烷失电子和氧离子反应生成二氧化碳和水;
(4)用惰性电极电解Mg(NO3)2和NaCl的混合溶液,阳极上氯离子放电生成氯气,阴极上氢离子放电生成氢气,且阴极附近生成的氢氧根离子和镁离子结合生成氢氧化镁沉淀.
解答 解:(1)①2C3H8(g)+7O2(g)═6CO(g)+8H2O (l)△H1=-2741.8kJ/mol
②2CO (g)+O2(g)═2CO2(g)△H2=-566kJ/mol
将方程式$\frac{①+3②}{2}$得反应方程式C3H8(g)+5O2(g)═3CO2(g)+4H2O(l),
△H=$\frac{-(2741.8+2×566)kJ/mol}{2}$=-2219.9kJ/mol,
故答案为:-2219.9kJ/mol;
(2)①a.该反应前后气体计量数之和不变,所以无论是否达到平衡状态,反应体系中的压强始终不变,不能据此判断平衡状态,故错误;
b.V正(H2)=V 逆(CO)=V逆(H2),正逆反应速率相等,该反应达到平衡状态,故正确;
c.该反应前后气体计量数之和不变,所以无论是否达到平衡状态,混合气体的平均相对分子质量始终不发生变化,不能据此判断平衡状态,故错误;
d.CO2的浓度不再发生变化,正逆反应速率相等,该反应达到平衡状态,故正确;
故选bd;
②氢气反应速率=$\frac{\frac{0.8mol}{1L}}{5min}$=0.16mol/(L.min),同一化学反应中同一时间段内各物质的反应速率之比等于其计量数之比,所以v(H2O)=0.16mol/(L.min);
根据H原子守恒知,生成n(H2O)=4n(C3H8)=4mol,
CO(g)+H2O(g)?CO2(g)+H2(g)
开始(mol/L)1 4 2 0
反应(mol/L)0.8 0.8 0.8 0.8
平衡(mol/L)0.2 3.2 2.8 0.8
化学平衡常数K=$\frac{c(C{O}_{2}).c({H}_{2})}{c(CO).c({H}_{2}O)}$=$\frac{2.8×0.8}{0.2×3.2}$3.5,
故答案为:0.16mol/(L.min);3.5;
③化学平衡常数只与温度有关,温度相等其化学平衡常数相等,所以化学平衡常数不变,
故答案为:不变;
(3)原电池中阴离子向负极移动、阳离子向正极移动,所以氧离子由正极向负极移动;
所有的燃料电池中,负极上通入燃料、正极上通入氧化剂,该燃料电池中,负极上丙烷失电子和氧离子反应生成二氧化碳和水,电极反应式为 C3H8+10O2--20e-═3CO2+4H2O,
故答案为:正;负;C3H8+10O2--20e-═3CO2+4H2O;
(4)用惰性电极电解Mg(NO3)2和NaCl的混合溶液,阳极上氯离子放电生成氯气,阴极上氢离子放电生成氢气,且阴极附近生成的氢氧根离子和镁离子结合生成氢氧化镁沉淀,所以阴极上有无色气体生成,有白色沉淀生成,
故答案为:有无色气体生成,有白色沉淀生成.
点评 本题考查化学平衡计算、原电池和电解池原理,为高频考点,侧重考查基本理论,知道平衡状态判断标准及电极反应式的书写是解本题关键,难点是电极反应式的书写,注意(4)中阴极区还生成沉淀,为易错点.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 20mL0.5mol/L的CaCl2溶液 | B. | 50mL0.5 mol/L的AlCl3溶液 | ||
| C. | 100mL2mol/L的NaCl溶液 | D. | 1L0.2mol/L的KCl溶液 |
| A. | m mol | B. | 2m mol | C. | 3m mol | D. | 4m mol |
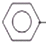 CH2CH3(g)$\stackrel{催化剂}{?}$
CH2CH3(g)$\stackrel{催化剂}{?}$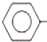 CH=CH2(g)+H2(g)
CH=CH2(g)+H2(g)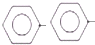
(1)已知
| 化学键 | C-H | C-C | C=C | H-H |
| 键能/kJ•molˉ1 | 412 | 348 | 612 | 436 |
(2)维持体系总压强p恒定,在温度T时,物质的量为n、体积为V的乙苯蒸汽发生催化脱氢反应.已知乙苯的平衡转化率为α,则在该温度下反应的平衡常数K=$\frac{n{α}^{2}}{(1-{α}^{2})V}$(用α等符号表示).
(3)工业上,通常在乙苯蒸汽中掺混水蒸气(原料气中乙苯和水蒸气的物质的量之比为1:9),控制反应温度600℃,并保持体系总压为常压的条件下进行反应.在不同反应温度下,乙苯的平衡转化率和某催化剂作用下苯乙烯的选择性(指除了H2以外的产物中苯乙烯的物质的量分数)示意图如下:
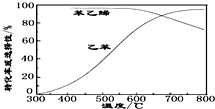
①掺入水蒸气能提高乙苯的平衡转化率,解释说明该事实正反应为气体分子数增大的反应,保持压强不变,加入水蒸气,容器体积应增大,等效为降低压强,平衡向正反应方向移动.
②控制反应温度为600℃的理由是600℃时乙苯的转化率与苯乙烯的选择性均较高,温度过低,反应速率较慢,转化率较低,温度过高,选择性下降,高温下可能失催化剂失去活性,且消耗能量较大.
(4)某研究机构用CO2代替水蒸气开发了绿色化学合成工艺----乙苯-二氧化碳耦合催化脱氢制苯乙烯.保持常压和原料气比例不变,与掺水蒸汽工艺相比,在相同的生产效率下,可降低操作温度;该工艺中还能够发生反应:CO2+H2=CO+H2O,CO2+C=2CO.新工艺的特点有①②③④(填编号).
①CO2与H2反应,使乙苯脱氢反应的化学平衡右移
②不用高温水蒸气,可降低能量消耗
③有利于减少积炭
④有利用CO2资源利用.
| A. | 稀硫酸 | B. | 氯化钠 | C. | 硝酸钾 | D. | 氯化铜 |
| A. | 有机高分子材料 | B. | 无机非金属材料 | C. | 金属材料 |
| A. | 1:2 | B. | 2:1 | C. | 1:1 | D. | 2:3 |