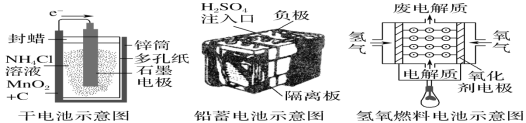
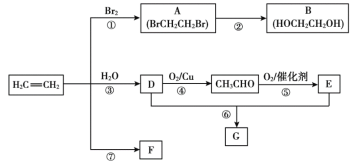
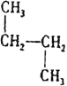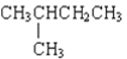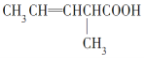题目内容
【题目】W、M、X、Y、Z是周期表前36号元素中的四种常见元素,其原子序数依次增大。W的一种核素在考古时常用来鉴定一些文物的年代;M的氧化物是导致酸雨的主要物质之一。X的某一种单质在高空大气层中保护人类免遭太阳光中紫外线的强烈侵袭;Y的基态原子核外有6个原子轨道处于半充满状态;Z能形成红色的Z2O和黑色的ZO两种氧化物。
(1)Y3+基态价电子排布式可表示为_____。
(2)MX3-的空间构型是_________;H2X分子的空间构型为__________。
(3)从核外电子排布角度解释高温下Z2O比ZO更稳定的原因_________。
(4)AlP因杀虫效率高、廉价易得而被广泛应用。已知AlP的熔点为2000℃,其晶胞结构如图所示。
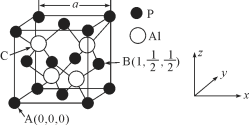
①磷化铝的晶体类型为_____。
②A、B点的原子坐标如图所示,则C点的原子坐标为____。
③磷化铝的晶胞参数a=546.35pm(1pm=10-12m),其密度为_____g/cm3(列出计算式即可,用NA表示阿伏加德罗常数的数值)。
【答案】3d3 平面正三角形 V形或折线形 Cu+的最外层电子排布为3d10,而Cu2+的最外层电子排布为3d9,因最外层电子排布达到全满时稳定,所以固态Cu2O稳定性强于CuO 原子晶体 (1/4,1/4,3/4) ![]()
【解析】
W、M、X、Y、Z是周期表前36号元素中的四种常见元素,其原子序数依次增大。W的一种核素在考古时常用来鉴定一些文物的年代,则W为C元素;X的某一种单质在高空大气层中保护人类免遭太阳光中紫外线的强烈侵袭,则X为O元素;M的氧化物是导致酸雨的主要物质之一,原子序数小于O,故M为N元素;Z能形成红色的Z2O和黑色的ZO两种氧化物,则Z为Cu元素;Y的基态原子核外有6个原子轨道处于半充满状态,原子序数小于Cu,其核外电子排布式为1s22s22p63s23p63d54s1,则Y为Cr元素,据此答题。
有分析可知:W为C元素,M为N元素,X为O元素,Y为Cr元素,Z为Cu元素。
(1)Y为Cr元素,Cr的原子序数为24,Cr原子基态的电子排布式为:1s22s22p63s23p63d54s1,Cr原子失去3个电子变成Cr3+,所以Cr3+基态的电子排布式为1s22s22p63s23p63d3,故答案为:1s22s22p63s23p63d3。
(2)NO3-中N原子价层电子对数=3+(5+1-2×3)/2=3,N原子没有孤对电子,故其空间构型为平面三角形,H2O分子中价层电子对为6+2/2=4,孤对电子数为(6-2×1)/2=2,为V形或折线形,故答案为:平面三角形;V形或折线形。
(3)轨道中电子排布达到全满、半满、全空时原子最稳定,Cu+的最外层电子排布为3d10,而Cu2+的最外层电子排布为3d9,因最外层电子排布达到全满时稳定,所以固态Cu2O稳定性强于CuO,故答案为:Cu+的最外层电子排布为3d10,而Cu2+的最外层电子排布为3d9,因最外层电子排布达到全满时稳定,所以固态Cu2O稳定性强于CuO。
(4)①AlP晶体熔点为2000℃,且晶胞中形成的是立体网状结构,应为原子晶体,故答案为:原子晶体。
②A、B点的原子坐标分别为(0,0,0)、(1,![]() ,
,![]() ),可知晶胞边长为1,由此可推知C点的原子坐标为(
),可知晶胞边长为1,由此可推知C点的原子坐标为(![]() ,
,![]() ,
,![]() ),故答案为:(
),故答案为:(![]() ,
,![]() ,
,![]() )。
)。
③晶胞中含有P原子数为8×![]() +6×
+6×![]() =4,Al原子数也为4,则1mol胞的质量为4×(27+31)g=4×58g,晶胞的体积为(5.4635×10-8)3cm3,晶胞密度为
=4,Al原子数也为4,则1mol胞的质量为4×(27+31)g=4×58g,晶胞的体积为(5.4635×10-8)3cm3,晶胞密度为![]() g/cm3,故答案为:
g/cm3,故答案为:![]() 。
。

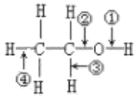
【题目】表格中如图是乙醇分子的化学键断键位置的示意图。下列对乙醇发生反应时的反应条件、断键方式及主要有机产物的叙述中错误的是( )
选项 | 反应条件 | 断键位置 | 主要有机产物 | 乙醇的分子结构 |
A.与钠反应 | 常温 | ① | CH3CH2ONa |
|
B.催化氧化 | Cu或Ag | ②③ | CH3COOH | |
C.消除反应 | 浓硫酸,170℃ | ③④ | CH2=CH2 | |
D.与HBr反应 | △ | ② | CH3CH2ONa |
A.AB.BC.CD.D