��Ŀ����
����Ŀ����֪A��B��C��D��ԭ������������������ֶ���������Ԫ�أ�A������������������������Bԭ�ӵļ۵����Ų�Ϊnsnnpn��D�ǵؿ��к�������Ԫ�ء�E�ǵ�������Ԫ���������ֻ��2�ԳɶԵ��ӣ�FԪ����CrԪ��λ��ͬһ���ڵĸ���Ԫ�����һ�̬ԭ�ӵ�������������Crԭ����ͬ��
��1��B��C��D��Ԫ�ص�һ�������ɴ�С��˳��Ϊ ����Ԫ�ط��ű�ʾ��
��2��BD32-����ԭ���ӻ����������Ϊ________�ӻ���CA4+�Ŀռ乹��Ϊ______________��
��3����̬Eԭ�ӵļ۵����Ų�ͼ______________________________��
��4��1mol BC���к��Цм�����ĿΪ______________��
��5�Ƚ�D��EԪ������⻯��ķе�ߵͣ� ���û�ѧʽ��ʾ����
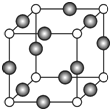
��6��C��F��Ԫ���γɵ�ij������ľ����ṹ��ͼ��ʾ������ΪCԭ�ӡ���û�����Ļ�ѧʽ�� ��Cԭ�ӵ���λ���� ��������Cԭ�Ӻ�Fԭ�Ӽ�ľ���Ϊa cm������٤������ΪNA����þ�����ܶ�Ϊ________________g��cm3���ú�a��NA�ķ��ű�ʾ����
���𰸡���1��N��O��C ��2��sp2 �������� ��3��![]() ��4��2NA
��4��2NA
��5��H2O��H2Se ��6��Cu3N 6 ![]()
��������
���������A������������������������ӦΪHԪ�أ�Bԭ�ӵļ۵����Ų�Ϊnsnnpn��n=2��ӦΪCԪ�أ�D�ǵؿ��к�������Ԫ�أ�ӦΪOԪ�أ���CΪNԪ�أ�E�ǵ������ڵ�p��Ԫ���������ֻ��2�ԳɶԵ��ӣ�ӦΪSeԪ�أ�FԪ�صĻ�̬ԭ�ӵ����ܲ�ֻ��һ�����ӣ������ܲ���ѳ������ӣ�ΪCuԪ�أ�
��1��ͬ����Ԫ�ش�����Ԫ�صĵ�һ����������������Oԭ�Ӻ���۵����Ų�ʽ2s22p4����Nԭ�Ӻ���۵����Ų�ʽ2s22p3��2p�Dz����ڰ�������ȶ��ṹ����ʧȥһ�����ӣ���˵�һ�����ܽϴ��ΪNԪ�أ���˳��ΪN��O��C��
��2��CO32-����ԭ���γ�3���Ҽ����µ��Ӷ���Ϊ![]() =0���ӻ����������Ϊsp2��NH4+����ԭ���γ�4���Ҽ����ռ乹��Ϊ�������壻
=0���ӻ����������Ϊsp2��NH4+����ԭ���γ�4���Ҽ����ռ乹��Ϊ�������壻
��3�������Ϸ�����֪EΪSeԪ�أ��������6�����ӣ��۵����Ų�ͼΪ![]() ��
��
��4��CN-��N2Ϊ�ȵ����壬����C��N������1mol BC-�к��Цм�����ĿΪ2NA��
��5���ǽ�����O��S��Ԫ�صķǽ�����Խǿ������Խ��Ӧ���⻯��Խ�ȶ�����H2O��H2Se��
��6���ɾ����ṹ��֪��Nԭ��λ�ڶ��㣬����Ϊ8��=1��Cuλ���⣬����Ϊ12��=3����ѧʽΪCu3N��������λ�ڶ�������ĵ�λ���������Nԭ�ӵ���λ����6��������Cԭ�Ӻ�Fԭ�Ӽ�ľ���Ϊa cm����߳�Ϊ2acm�����������Ϊ8a3cm3������������Ϊ![]() g�����ܶ�Ϊ
g�����ܶ�Ϊ![]() g/cm3=
g/cm3=![]() g/cm3��
g/cm3��

 ��1����Ԫ�¿�������ĩϵ�д�
��1����Ԫ�¿�������ĩϵ�д�����Ŀ������̿�ɴ���������Ⱦ��NO��T��ʱ����1L�ܱ������м���NO�����̿�ۣ�������Ӧ������������A��B����ø����ʵ����ʵ������£�
����̿/mol | NO/mol | A/mol | B/mol | |
��ʼ״̬ | 2.030 | 0.100 | 0 | 0 |
2 minʱ | 2.000 | 0.040 | 0.030 | 0.030 |
��1��2 min�ڣ���NO��ʾ�÷�Ӧ��ƽ������v(NO)�� mol��L-1��min-1��
��2���÷�Ӧ�Ļ�ѧ����ʽ��________________________________________��
��3��һ�������£����ܱպ��ݵ������У��ܱ�ʾ������Ӧ�ﵽ��ѧƽ��״̬����_____ ��
��v(NO)��v(A)��v(B)=2��1��1
�����������ܶȲ��ٸı�
����ѹǿ���ٸı�
����������ƽ����Է����������ٸı�
��4��̼Ԫ�ؿ��γ������ڶ࣬�ֲ�������л���������м״��dz�����ȼ�ϣ��״�ȼ�ϵ�صĽṹʾ��ͼ���£�һ��ͨ��״�������һ��ͨ���������������Һ��ϡ���ᣬ��ع���ʱ�ܷ�Ӧʽ��2CH3OH��3O2��2CO2��4H2O��

��a��ͨ���������____���缫��ӦʽΪ��______��
��b���缫��ӦʽΪ_________________________��
�۵�ع���ʱH���� ������ ������������������