题目内容
合成氨是人类科学技术上的一项重大突破,其反应原理为N2(g)+3H2(g)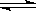 2NH3(g) ΔH=-92.4 kJ·mol-1。一种工业合成氨的简式流程图如下:
2NH3(g) ΔH=-92.4 kJ·mol-1。一种工业合成氨的简式流程图如下:
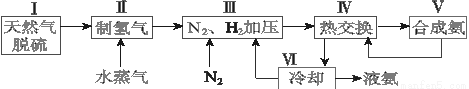
(1)天然气中的H2S杂质常用氨水吸收,产物为NH4HS。一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式:_______________。
(2)步骤Ⅱ中制氢气的原理如下:
①CH4(g)+H2O(g)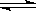 CO(g)+3H2(g) ΔH=+206.4 kJ·mol-1
CO(g)+3H2(g) ΔH=+206.4 kJ·mol-1
②CO(g)+H2O(g)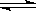 CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1
CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1
对于反应①,一定可以提高平衡体系中H2的百分含量,又能加快反应速率的措施是 __。
利用反应②,将CO进一步转化,可提高H2的产量。若1 mol CO和H2的混合气体(CO的体积分数为20%)与H2O反应,得到1.18 mol CO、CO2和H2的混合气体,则CO的转化率为____________。
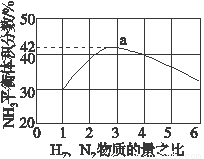
(3)如图表示500 ℃、60.0 MPa条件下,原料气投料比与平衡时NH3体积分数的关系。根据图中a点数据计算N2的平衡体积分数:______________。
(4)上述流程图中,使合成氨放出的能量得到充分利用的主要步骤是(填序号)_____________。简述本流程中提高合成氨原料总转化率的方法:_________________。
| A. | 有Al、Cu、稀H2SO4组成原电池,其负极反应式为:Al-3e-═Al3+ | |
| B. | Mg、Al、NaOH溶液组成原电池,其负极反应式为:Al-3e-═Al3+ | |
| C. | 由Fe、Cu、FeCl3溶液组成原电池,其负极反应式为:Cu-2e-═Cu2+ | |
| D. | 由Al、Cu、浓硝酸组成原电池,其负极反应式为:Cu-2e-═Cu2+ |
| A. | 新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分振荡后溶液呈红色 | |
| B. | 配制溶液时,若加水超过容量瓶刻度,应用胶头滴管将多余溶液吸出 | |
| C. | 煤油可由石油分馏获得,可用作燃料和保存少量金属钠 | |
| D. | 检验某溶液是否含有SO42-时,应取少量该溶液,依次加入BaCl2溶液和稀盐酸 |
把温度为20℃,浓度为1.0mol·L-1的H2SO4和2.2mol·L-1的碱溶液各50ml混合(溶液密度均为1g·ml-1,比热容为4.184kJ·K-1·kg-1),轻轻搅动。测得酸碱混合液的温度变化数据如下:
反应物 | 起始温度t1℃ | 终止温度t2℃ |
H2SO4+NaOH | 20 | 33.6 |
H2SO4+NH3·H2O | 20 | 32.6 |
则反应NH3·H2O=NH4++OH-的焓变约为( )(单位:kJ·mol-1)
A.2.1 B.4.2 C.52.7 D. 缺少数据无法计算


 ;
;  ;
; 
 3Z(g)平衡时X、Y、Z的体积分数分别为30%、60%、10%.在此平衡体系中又加入1molZ(g),再达平衡后,X、Y、Z的体积分数不
3Z(g)平衡时X、Y、Z的体积分数分别为30%、60%、10%.在此平衡体系中又加入1molZ(g),再达平衡后,X、Y、Z的体积分数不 变。下列不正确的是( )
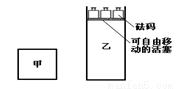
变。下列不正确的是( ) C(g)+3D(g);ΔH<0。现将2 mol A和2 mol B充入体积为V的甲容器,将2 mol C和6 mol D充入乙容器并使乙容器在反应开始前的体积为2V(如图1)。
C(g)+3D(g);ΔH<0。现将2 mol A和2 mol B充入体积为V的甲容器,将2 mol C和6 mol D充入乙容器并使乙容器在反应开始前的体积为2V(如图1)。