题目内容
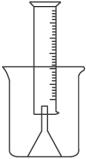
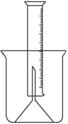
(14分)测定一定质量的铝锌合金与强酸溶液反应产生的氢气的体积,可以求得合金中铝和锌的质量分数及物质的量分数。现有下列实验用品:中学化学实验常用仪器、1000 mL烧杯、100 mL量筒、短颈玻璃漏斗、铜网、铝锌合金样品、浓盐酸(密度1.19 g·cm-3)、水。按图示装置进行实验,回答下列问题。(设合金样品完全反应,产生的气体体积不超过100 mL)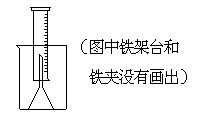
(1).补充下列实验步骤,直到反应开始进行(铁架台和铁夹的安装可省略):
①将称量后的合金样品用铜网小心包裹好,放在1000 mL烧杯底部,把短颈漏斗倒扣在样品上面。
②_________________________________________________________________________。
③_________________________________________________________________________。
④_________________________________________________________________________。
(2).合金样品用铜网包裹的目的是什么?
________________________________________________________________________。
(3).已知一定质量的铝锌合金的总物质的量为n,实验测得的气体体积为V1mL(已经换算为标准状况)。则铝锌合金中铝的物质的量分数为:_________________。(用含n和V1的式子表示)
(4)本装置也可用于测定金属锌(或其它金属)的相对原子质量,若m g金属锌进行实验,测得的气体体积为V2mL(已经换算为标准状况)。则金属锌的相对原子质量为:_________________。(用含m和V2的式子表示)
(1)氢气用向下排空气法或排水法收集,又因为需要测量氢气的体积,所以要借助于量筒。正确的步骤是:②往烧杯中加水直至水浸没漏斗颈。③在100ml量筒中装满水,倒置在盛水的烧杯中(量筒中不应留有气泡),使漏斗颈插入量筒中,烧杯中水面到杯口至少保留约100ml空间。④将长颈漏斗(玻璃棒)插入烧杯并接近烧杯底部,通过条慢慢加入浓盐酸,至有气体产生。
(2)使样品在反应时能保持在烧杯底部适当位置(或避免反应时样品漂浮)。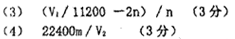
解析

 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案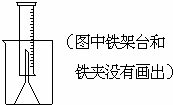 测定一定质量的铝锌合金与强酸溶液反应产生的氢气的体积,可以求得合金中铝和锌的质量分数.现有下列实验用品:中学化学实验常用仪器.800毫升烧杯.100毫升量筒.短颈玻璃漏斗.铜网.铝锌合金样品.浓盐酸(密度1.19克/毫升).水.按图示装置进行实验,回答下列问题.(设合金样品完全反应,产生的气体体积不超过100毫升)
测定一定质量的铝锌合金与强酸溶液反应产生的氢气的体积,可以求得合金中铝和锌的质量分数.现有下列实验用品:中学化学实验常用仪器.800毫升烧杯.100毫升量筒.短颈玻璃漏斗.铜网.铝锌合金样品.浓盐酸(密度1.19克/毫升).水.按图示装置进行实验,回答下列问题.(设合金样品完全反应,产生的气体体积不超过100毫升)