题目内容
(8分)铜能与稀硝酸反应,反应方程式为:
3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,当有9.6克Cu参加反应时,
求:
(1)产生气体在标准状况下的体积
(2)被还原的硝酸的质量
3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,当有9.6克Cu参加反应时,
求:
(1)产生气体在标准状况下的体积
(2)被还原的硝酸的质量
(1)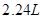 (2)6.3g
(2)6.3g
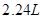 (2)6.3g
(2)6.3g考查根据方程式进行的有关计算。稀硝酸具有氢氧化性,能氧化铜生成硝酸铜、NO和水,这说明硝酸没有被完全还原,据此可以进行有关计算。
9.6g铜是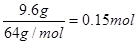 ,铜和稀硝酸反应的发生为
,铜和稀硝酸反应的发生为
3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
3mol 8mol 2×22.4L
0.15ml n(HNO3) V(NO)
(1)所以产生气体在标准状况下的体积为V(NO)=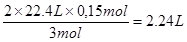
(2)参加反应的硝酸是n(HNO3)=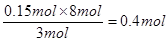
根据方程式可知被还原的硝酸是参加反应的硝酸的1/4
所以被还原的硝酸的物质的量是1/4×0.4mol=0.1mol
其质量是0.1mol×63g/mol=6.3g
9.6g铜是
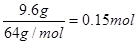 ,铜和稀硝酸反应的发生为
,铜和稀硝酸反应的发生为3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
3mol 8mol 2×22.4L
0.15ml n(HNO3) V(NO)
(1)所以产生气体在标准状况下的体积为V(NO)=
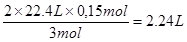
(2)参加反应的硝酸是n(HNO3)=
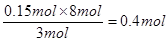
根据方程式可知被还原的硝酸是参加反应的硝酸的1/4
所以被还原的硝酸的物质的量是1/4×0.4mol=0.1mol
其质量是0.1mol×63g/mol=6.3g

练习册系列答案
相关题目
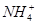 ②H2O ③NH3 ④NH3·H2O ⑤H+ ⑥OH-
②H2O ③NH3 ④NH3·H2O ⑤H+ ⑥OH- CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O 黑磷,黑磷比白磷稳定.结构与石墨相似,下列叙述正确的是 填选项字母)
黑磷,黑磷比白磷稳定.结构与石墨相似,下列叙述正确的是 填选项字母)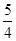 O2(g)=
O2(g)=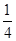 P4O10(s);△H=-739KJ·mol-1
P4O10(s);△H=-739KJ·mol-1