题目内容
在下列反应中,氨做还原剂的是( )。A、
△
NH3+HCl=
NH4Cl
B、 2NH3+3CuO===3Cu+N2+3H2O
C、2NH3+2Na=2NaNH2+H2
D、 NH3+NaH=NaNH2+H2
答案:B
提示:
提示:
| 氨做还原剂时,其中的氮元素或者氢元素化合价升高,只有B符合题意,答案为B。
|

练习册系列答案
 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案
相关题目
 H++B(OH)4-,该反应中的碱是
H++B(OH)4-,该反应中的碱是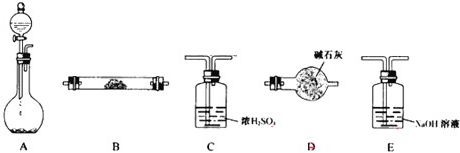

 H++B(OH)4-,该反应中的碱是______(填H3BO3或H2O);
H++B(OH)4-,该反应中的碱是______(填H3BO3或H2O);