题目内容
【题目】
(1)在上面元素周期表中全部是金属元素的区域为___。
A.a B.b C.c D.d
(2)G元素与E元素形成的化合物的化学式是___、___,它们都是___。(填“共价化合物”或“离子化合物”)。表格中九种元素的最高价氧化物对应的水化物中,碱性最强的是___(用化合物的化学式表示,下同),酸性最强的是___,属于两性氢氧化物的是___。
(3)①用元素符号将铁元素填写在上面元素周期表中对应的位置___。
②G、H两元素相比较,金属性较强的是___(填名称),可以验证该结论的实验是___。(填编号)
(a)看哪种原子失去的电子越多,金属性越强。
(b)将这两种元素的单质粉末分别和同浓度的盐酸反应
(c)将这两种元素的单质粉末分别和热水作用,并滴入酚酞溶液
(d)比较这两种元素的气态氢化物的稳定性
【答案】b Na2O2 Na2O 离子化合物 NaOH HClO4 Al(OH)3 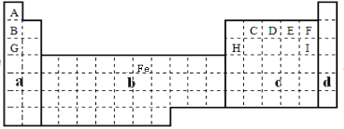 钠 bc
钠 bc
【解析】
(1)a区域为第ⅠA族和第ⅡA族,包含的H元素为非金属元素;c区域为第ⅢA族到第ⅦA族,d区域为0族,均含非金属元素,只有b区域为过渡元素,全部为金属元素;
(2)G为Na、E为O,可形成过氧化钠、氧化钠,表中A-I九种元素中,Na(G)的金属性最强,Al(H)的氢氧化物具有两性,Cl(I)的最高价氧化物对应的水化物酸性最强;
(3)①Fe的原子序数为26,原子结构中有4个电子层,最外层电子数是2;②Na的金属性大于 Al,可利用失去电子的难易、与酸、水反应的剧烈程度等进行比较。
根据以上分析解答此题。
(1)a区域为第ⅠA族和第ⅡA族,包含的H元素为非金属元素;c区域为第ⅢA族到第ⅦA族,d区域为0族,均含非金属元素,只有b区域为过渡元素,全部为金属元素。
(2)G为Na、E为O,可形成过氧化钠、氧化钠,化学式分别为Na2O2、Na2O,均由离子构成,均属于离子化合物;表中A-I九种元素的最高价氧化物对应的水化物中,碱性最强的是NaOH,酸性最强的是HClO4,属于两性氢氧化物的是Al(OH)3。
(3)①Fe的原子序数为26,原子结构中有4个电子层,最外层电子数是2,位于元素周期表第四周期第Ⅷ,位置如图: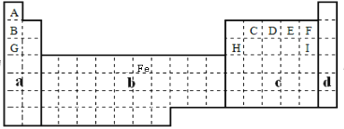
② G为钠元素,H为铝元素,都位于第三周期,同周期元素从左到右金属性依次减弱,所以金属性强的为钠;
(a)金属性的强弱与失去电子的难易有关,与失去电子的多少无关,(a)不能验证;
(b)将钠和铝的单质粉末分别和同浓度的盐酸反应,钠的金属性强反应剧烈,(b)能验证;
(c)将钠和铝的单质粉末分别和热水作用,并滴入酚酞溶液,钠与水反应生成氢氧化钠,酚酞溶液变红,铝不反应,(c)能验证;
(d)金属元素不存在气态氢化物,(d)说法错误;

【题目】氮的氧化物是造成大气污染的主要物质。研究氮氧化物的反应机理对于消除环境污染有重要意义。NO在空气中存在如下反应:2NO(g)+ O2(g)![]() 2NO2(g) △H,上述反应分两步完成,如图所示。
2NO2(g) △H,上述反应分两步完成,如图所示。

回答下列问题:
(1)写出反应①的热化学方程式(△H用含物理量E的等式表示):___________。
(2)反应①和反应②中,一个是快反应,会快速建立平衡状态,而另一个是慢反应。决定2NO(g)+O2(g)![]() 2NO2(g)反应速率的是____(填“反应①”或“反应②”);对该反应体系升高温度,发现总反应速率变慢,其原因可能是_________(反应未使用催化剂)。
2NO2(g)反应速率的是____(填“反应①”或“反应②”);对该反应体系升高温度,发现总反应速率变慢,其原因可能是_________(反应未使用催化剂)。
(3)T1温度时在容积为2L的恒容密闭容器中只充入1.00molNO2气体发生反应:2NO(g)+O2(g)![]() 2NO2(g)。实验测得:v正=k正c2(NO)·c(O2),v逆=k逆c2(NO2),k正、k逆为速率常数只受温度影响。不同时刻测得容器中n(NO2)如表:
2NO2(g)。实验测得:v正=k正c2(NO)·c(O2),v逆=k逆c2(NO2),k正、k逆为速率常数只受温度影响。不同时刻测得容器中n(NO2)如表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO2)/mol | 1.00 | 0.80 | 0.65 | 0.55 | 0.50 | 0.50 |
①从0~2s该反应的平均速率v(NO2)=___________mol/(L·s)。
②T1温度时化学平衡常数K=___________mol-1·L。
③化学平衡常数K与速率常数![]() 、
、![]() 的数学关系是K=___________。若将容器的温度改变为T2时其
的数学关系是K=___________。若将容器的温度改变为T2时其![]() =
=![]() ,则T1__________T2 (填“>”、“<”或“=”)。
,则T1__________T2 (填“>”、“<”或“=”)。
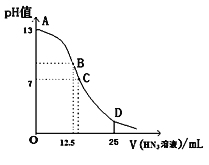
(4)水能部分吸收NO、NO2混合气体得到HNO2溶液。向20 mL 0.10 mol/LHNO2溶液中逐滴加入0.10 mol·L-1 NaOH溶液,所得pH曲线如图所示。则A点对应的溶液中![]() =_______。
=_______。