题目内容
【题目】我国具有悠久的历史,在西汉就有湿法炼铜(Fe+CuSO4=Cu+FeSO4),试回答下列问题。
(1)Cu2+的未成对电子数有______个,H、O、S电负性由大到小的顺序为_______。
(2)在硫酸铜溶液中滴加过量氨水可形成[Cu(NH3)4]SO4蓝色溶液。[Cu(NH3)4]SO4中化学键类型有_______,阴离子中心原子杂化类型为______。
(3)铁铜合金晶体类型为_____;铁的第三(I3)和第四(I4)电离能分别为2957kJ/mol、5290kJ/mol,比较数据并分析原因________________。
(4)金铜合金的一种晶体结构为立方晶型,如图所示。已知该合金的密度为dg/cm3,阿伏加德罗常数值为NA,两个金原子间最小间隙为apm(1pm=10-10cm)。则铜原子的半径为_______cm(写出计算表达式)。

【答案】1 O、S、H 共价键、配位键、离子键 sp3杂化 金属晶体 基态铁原子的价电子排布式为3d64s2,失去3个电子后核外电子呈半充满稳定状态,因此I4远大于I3 ![]()
【解析】
本题考查了电子排布、电负性、杂化轨道、晶胞计算等基础知识,晶胞棱长的计算是难点。有一定的难度。
(1)铜是29号元素,铜离子有27个电子,所以未成对的电子有1个。元素非金属性月去爱那个,其电负性越强,所以电负性顺序为: O、S、H。(2) [Cu(NH3)4]SO4中,[Cu(NH3)4]2+与硫酸根离子之间的化学键为离子键,[Cu(NH3)4]2+中铜离子与氨气之间的化学键为配位键,氮氢之间形成极性键,故答案为:共价键、配位键、离子键。阴离子中中心原子为硫,价层电子数为4+(6+2-4×2)/2=4,采用sp3杂化。 (3)铁通合金属于金属晶体。基态铁原子的价电子排布式为3d64s2,失去3个电子后核外电子呈半充满稳定状态,因此第四(I4)电离能远大于第三(I3)I3 电离能。(4) 设铜原子半径为xcm,金原子半径为ycm,则有棱长为2x+2x或2x+a,根据晶胞计算,晶胞含一个金原子,和3个铜原子,则一个晶胞的质量为389/NAg,则晶胞的棱长为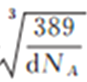 ,则有关系式2x+2y=
,则有关系式2x+2y= 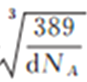 、2x+a×10-10=
、2x+a×10-10= 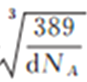 ,解y=
,解y=![]() 。
。


