题目内容
(普高完成)四种短周期元素的性质或结构信息如下表.请根据信息回答下列问题.
(1)B元素在周期表中的位置是
 .
.
(2)写出C单质与水反应的化学方程式
(3)D与酸反应的化学方程式为
(4)A、B两元素非金属性较强的是(写元素符号)
| 元素 | A | B | C | D |
| 性质或 结构 信息 |
室温下单质为黄色粉末状固体,加热易熔化;单质在氧气中燃烧,发出明亮的蓝紫色火焰,产生有刺激性气味的气体 | 单质常温、常压下是气体,能溶于水;原子的M层上有7个电子 | 单质质软、银白色固体、导电性强;单质在空气中燃烧发出黄色的火焰,生成淡黄色的固体 | 原子最外电子层有4个电子;其单质既能与酸反应,又能与碱反应 |
第三周期第ⅦA族
第三周期第ⅦA族
,写出C与氧气燃烧后产物的电子式

(2)写出C单质与水反应的化学方程式
2Na+2H2O=2NaOH+H2↑
2Na+2H2O=2NaOH+H2↑
.A与氢元素形成的化合物溶于水后,溶液的pH小于
小于
7(填“大于”“等于”或“小于”).(3)D与酸反应的化学方程式为
Si+4HF═SiF4↑+2H2↑
Si+4HF═SiF4↑+2H2↑
与NaOH反应的离子方程式为Si+2OH-+H2O=SiO32-+2H2↑
Si+2OH-+H2O=SiO32-+2H2↑
.(4)A、B两元素非金属性较强的是(写元素符号)
Cl
Cl
.写出其最高价氧化物对应水化物的酸性强弱HClO4的酸性>H2SO4的酸性
HClO4的酸性>H2SO4的酸性
.(用化学式表示)分析:先根据性质或结构信息判断A、B、C、D四种元素,
(1)根据原子结构示意图判断在周期表中的位置;
(2)根据物质的属性判断其水溶液的pH值;
(3)根据物质的性质写出其反应的化学方程式、离子方程式;
(4)根据元素周期律判断元素的非金属性强弱,其最高价氧化物的水化物的酸性强弱.
(1)根据原子结构示意图判断在周期表中的位置;
(2)根据物质的属性判断其水溶液的pH值;
(3)根据物质的性质写出其反应的化学方程式、离子方程式;
(4)根据元素周期律判断元素的非金属性强弱,其最高价氧化物的水化物的酸性强弱.
解答:解:元素A单质室温下为黄色粉末状固体,加热易熔化;单质在氧气中燃烧,发出明亮的蓝紫色火焰,产生有刺激性气味的气体,所以A为S元素;
元素B原子的M层上有7个电子,且单质常温、常压下是气体,能溶于水,所以B是Cl元素;
C元素单质在空气中燃烧发出黄色的火焰,生成淡黄色的固体,单质质软、银白色固体、导电性强,所以C为Na元素;
D元素原子最外电子层有4个电子,且是短周期元素,D元素为ⅣA元素,是C元素或Si元素,碳能与浓硫酸、浓硝酸反应,但不能与碱反应,硅能与HF酸反应,也能与NaOH反应,又因其单质既能与酸反应,又能与碱反应,所以为Si元素.
(1)B是Cl元素,原子结构示意图为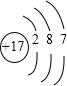 ,电子层数=周期数,最外层电子数=主族族序数,所以是第三周期第ⅦA族元素;Na与氧气燃烧后产物为Na2O2,电子式是
,电子层数=周期数,最外层电子数=主族族序数,所以是第三周期第ⅦA族元素;Na与氧气燃烧后产物为Na2O2,电子式是 ,故答案为:第三周期第第ⅦA族;
,故答案为:第三周期第第ⅦA族; ;
;
(2)C是钠,与水反应的方程式为:2Na+2H2O=2NaOH+H2↑,A是硫,与氢元素形成的化合物是H2S,溶于水后,溶液呈酸性,所以pH<7,
故答案为:2Na+2H2O=2NaOH+H2↑;小于;
(3)D是Si,可以HF反应,反应方程式为:Si+4HF═SiF4↑+2H2↑,Si和强碱反应生成盐和氢气,所以离子方程式为:Si+2OH-+H2O=SiO32-+2H2↑;
故答案为:Si+4HF═SiF4↑+2H2↑;Si+2OH-+H2O=SiO32-+2H2↑;
(4)A是S元素,B是Cl元素,根据元素周期律知,氯元素非金属性大于硫元素;
A、B两元素最高价氧化物对应水化物的酸分别是H2SO4、HClO4,HClO4的酸性>H2SO4的酸性.
故答案为:Cl;HClO4的酸性>H2SO4的酸性.
元素B原子的M层上有7个电子,且单质常温、常压下是气体,能溶于水,所以B是Cl元素;
C元素单质在空气中燃烧发出黄色的火焰,生成淡黄色的固体,单质质软、银白色固体、导电性强,所以C为Na元素;
D元素原子最外电子层有4个电子,且是短周期元素,D元素为ⅣA元素,是C元素或Si元素,碳能与浓硫酸、浓硝酸反应,但不能与碱反应,硅能与HF酸反应,也能与NaOH反应,又因其单质既能与酸反应,又能与碱反应,所以为Si元素.
(1)B是Cl元素,原子结构示意图为
 ,电子层数=周期数,最外层电子数=主族族序数,所以是第三周期第ⅦA族元素;Na与氧气燃烧后产物为Na2O2,电子式是
,电子层数=周期数,最外层电子数=主族族序数,所以是第三周期第ⅦA族元素;Na与氧气燃烧后产物为Na2O2,电子式是 ,故答案为:第三周期第第ⅦA族;
,故答案为:第三周期第第ⅦA族; ;
;(2)C是钠,与水反应的方程式为:2Na+2H2O=2NaOH+H2↑,A是硫,与氢元素形成的化合物是H2S,溶于水后,溶液呈酸性,所以pH<7,
故答案为:2Na+2H2O=2NaOH+H2↑;小于;
(3)D是Si,可以HF反应,反应方程式为:Si+4HF═SiF4↑+2H2↑,Si和强碱反应生成盐和氢气,所以离子方程式为:Si+2OH-+H2O=SiO32-+2H2↑;
故答案为:Si+4HF═SiF4↑+2H2↑;Si+2OH-+H2O=SiO32-+2H2↑;
(4)A是S元素,B是Cl元素,根据元素周期律知,氯元素非金属性大于硫元素;
A、B两元素最高价氧化物对应水化物的酸分别是H2SO4、HClO4,HClO4的酸性>H2SO4的酸性.
故答案为:Cl;HClO4的酸性>H2SO4的酸性.
点评:本题考查的是物质的结构与性质之间的关系,正确判断元素是解题的关键,要熟知元素周期表、元素周期律.

练习册系列答案
 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目
(普高完成)四种短周期元素的性质或结构信息如下表.请根据信息回答下列问题.
(1)B元素在周期表中的位置是______,写出C与氧气燃烧后产物的电子式______.
(2)写出C单质与水反应的化学方程式______.A与氢元素形成的化合物溶于水后,溶液的pH______7(填“大于”“等于”或“小于”).
(3)D与酸反应的化学方程式为______与NaOH反应的离子方程式为______.
(4)A、B两元素非金属性较强的是(写元素符号)______.写出其最高价氧化物对应水化物的酸性强弱______.(用化学式表示)
| 元素 | A | B | C | D |
| 性质或 结构 信息 | 室温下单质为黄色粉末状固体,加热易熔化;单质在氧气中燃烧,发出明亮的蓝紫色火焰,产生有刺激性气味的气体 | 单质常温、常压下是气体,能溶于水;原子的M层上有7个电子 | 单质质软、银白色固体、导电性强;单质在空气中燃烧发出黄色的火焰,生成淡黄色的固体 | 原子最外电子层有4个电子;其单质既能与酸反应,又能与碱反应 |
(2)写出C单质与水反应的化学方程式______.A与氢元素形成的化合物溶于水后,溶液的pH______7(填“大于”“等于”或“小于”).
(3)D与酸反应的化学方程式为______与NaOH反应的离子方程式为______.
(4)A、B两元素非金属性较强的是(写元素符号)______.写出其最高价氧化物对应水化物的酸性强弱______.(用化学式表示)