题目内容
A、B、C、D是核电荷数依次增大的四种短周期元索,已知A能形成多种氢化物,B原子的最外层电子数为6个电子,C是最强的非金属元素,D的最高价氧化物的水化物为用途最广的酸.试回答:(1)A、D两元素的符号为:A______,D______.
(2)钠与B元素形成的化合物Na2B2,的电子式为______.它在固态时属于______晶体,与AB2发生化学反应的方程式为______.
(3)A、B、C三种氢化物的稳定性由强到弱的顺序是______,四种元素的氢化物中沸点最高的氢化物是______(填化学式).
【答案】分析:A能形成多种氢化物,则A为C元素,能形成烃类化合物,C是最强的非金属元素,应为F元素,B原子的最外层电子数为6个电子,且核电核数小于F,则B应为O元素,D的最高价氧化物的水化物为用途最广的酸,且原子序数大于F,则应为S元素,对应的酸为硫酸,用途广泛,结合元素对应的单质、化合物的结构和性质以及元素周期律知识解答该题.
解答:解:A能形成多种氢化物,则A为C元素,能形成烃类化合物,C是最强的非金属元素,应为F元素,B原子的最外层电子数为6个电子,且核电核数小于F,则B应为O元素,D的最高价氧化物的水化物为用途最广的酸,且原子序数大于F,则应为S元素,对应的酸为硫酸,则
(1)由以上分析可知,A为C元素,D为S元素,故答案为:C,S;
(2)Na2O2为离子化合物,电子式为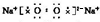 ,易与CO2反应生成Na2CO3和O2,反应的化学方程式为2Na2O2+2CO2=2Na2CO3+O2,
,易与CO2反应生成Na2CO3和O2,反应的化学方程式为2Na2O2+2CO2=2Na2CO3+O2,
故答案为: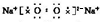 ;离子;2Na2O2+2CO2=2Na2CO3+O2;
;离子;2Na2O2+2CO2=2Na2CO3+O2;
(3)A、B、C对应的氢化物分别为CH4、H2O、HF,由于非金属性:F>O>C,则稳定性:HF>H2O>CH4,三种氢化物中,
H2O在常温下为液态,沸点最高,故答案为:HF>H2O>CH4;H2O.
点评:本题考查原子结构与元素周期律知识,题目难度中等,本题侧重于元素对应的单质、化合物的性质考查元素的种类,同时考查元素周期律知识,学习中注意相关基础知识的积累.
解答:解:A能形成多种氢化物,则A为C元素,能形成烃类化合物,C是最强的非金属元素,应为F元素,B原子的最外层电子数为6个电子,且核电核数小于F,则B应为O元素,D的最高价氧化物的水化物为用途最广的酸,且原子序数大于F,则应为S元素,对应的酸为硫酸,则
(1)由以上分析可知,A为C元素,D为S元素,故答案为:C,S;
(2)Na2O2为离子化合物,电子式为
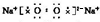 ,易与CO2反应生成Na2CO3和O2,反应的化学方程式为2Na2O2+2CO2=2Na2CO3+O2,
,易与CO2反应生成Na2CO3和O2,反应的化学方程式为2Na2O2+2CO2=2Na2CO3+O2,故答案为:
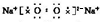 ;离子;2Na2O2+2CO2=2Na2CO3+O2;
;离子;2Na2O2+2CO2=2Na2CO3+O2;(3)A、B、C对应的氢化物分别为CH4、H2O、HF,由于非金属性:F>O>C,则稳定性:HF>H2O>CH4,三种氢化物中,
H2O在常温下为液态,沸点最高,故答案为:HF>H2O>CH4;H2O.
点评:本题考查原子结构与元素周期律知识,题目难度中等,本题侧重于元素对应的单质、化合物的性质考查元素的种类,同时考查元素周期律知识,学习中注意相关基础知识的积累.

练习册系列答案
相关题目