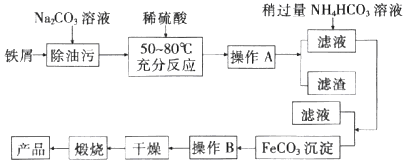
题目内容
【题目】下列方程式书写正确的是( )
A.NaHSO4在水溶液中的电离方程式:NaHSO4=Na++HSO4-
B.H2SO3的电离方程式:H2SO3![]() 2H++SO32-
2H++SO32-
C.CO32-的水解方程式:CO32-+H2O![]() HCO3-+OH-
HCO3-+OH-
D.CaCO3的电离方程式:CaCO3![]() Ca2++CO32-
Ca2++CO32-
【答案】C
【解析】
A选项,NaHSO4在水溶液中的电离方程式:NaHSO4=Na++H++SO42-,故A错误;
B选项,多元弱酸的电离一步一步电离,因此H2SO3的电离方程式:H2SO3![]() H++HSO3-,故B错误;
H++HSO3-,故B错误;
C选项,多元弱酸酸根离子水解一步一步水解,因此CO32-的水解方程式:CO32-+H2O![]() HCO3-+OH-,故C正确;
HCO3-+OH-,故C正确;
D选项,CaCO3是强电解质,全部电离,电离电离方程式:CaCO3 = Ca2++CO32-,故D错误;
综上所述,答案为C。

 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案【题目】参考下列图表和有关要求回答问题:
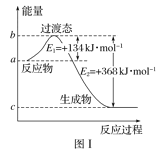
(1)图Ⅰ是1molNO2(g)和1molCO(g)反应生成CO2和NO过程中能量变化示意图,若在反应体系中加入催化剂,反应速率增大,E1的变化是___(填“增大”“减小”或“不变”,下同),ΔH的变化是__。请写出NO2和CO反应的热化学方程式:__。
(2)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH=+49.0kJ·mol-1
②CH3OH(g)+![]() O2(g)=CO2(g)+2H2(g) ΔH=-192.9kJ·mol-1
O2(g)=CO2(g)+2H2(g) ΔH=-192.9kJ·mol-1
又知③H2O(g)=H2O(l) ΔH=-44kJ·mol-1
则甲醇燃烧生成液态水的热化学方程式:___。
(3)下表是部分化学键的键能数据:
化学键 | P—P | P—O | O=O | P=O |
键能/kJ·mol-1 | a | b | c | x |
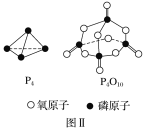
已知1mol白磷(P4)完全燃烧放热为dkJ,白磷及其完全燃烧的产物结构如图Ⅱ所示,则表中x=___kJ·mol-1(用含有a、b、c、d的代数式表示)。
【题目】对下列现象或事实的解释正确的是![]()
选项 | 现象或事实 | 解释 |
A | 用热的纯碱溶液洗去油污 |
|
B | 漂白粉在空气中久置变质 | 漂白粉中的 |
C | 施肥时,草木灰 |
|
D | 钢铁在潮湿的空气中容易生锈 | 钢铁在空气中发生了析氢腐蚀 |
A.AB.BC.CD.D
【题目】下表是不同温度下水的离子积数据:
温度/℃ | 25 | t1 | t2 |
水的离子积常数 | 1×10-14 | α | 1×10-12 |
试回答以下问题:
(1)若25<t1<t2,则α____(填“<”“>”或“=”)1×10-14,作出此判断的理由是___________________。
(2)25 ℃下,某Na2SO4溶液中c(![]() )=5×10-4mol·L-1,取该溶液1 mL,加水稀释至10 mL,则稀释后溶液中c(Na+)∶c(OH-)=________。
)=5×10-4mol·L-1,取该溶液1 mL,加水稀释至10 mL,则稀释后溶液中c(Na+)∶c(OH-)=________。
(3)t2 ℃下,将pH=11的苛性钠溶液V1 L与pH=1的稀硫酸V2 L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1∶V2=________。此溶液中各种离子的浓度由大到小的排列顺序是_____________________。
(4)相同温度下等物质的量浓度的下列溶液中,
A、NH4Cl B、NH4HCO3 (溶液呈碱性) C、NH4HSO4 D、(NH4)2SO4
NH4+离子浓度由大到小的顺序是_______________(用对应的字母填写)