题目内容
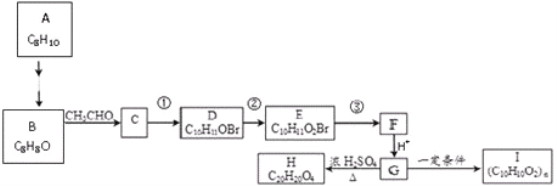
【题目】利用反应6NO2+8NH3=7N2+12H2O构成电池的装置如下图所示。此方法既能实现有效清除氮氧化物的排放,减轻环污染,又能充分利用化学能。下列说法正确的是( )

A.电流从左侧A电极经过负载后流向右侧B电极
B.电极B为正极,发生还原反应
C.电极A极反应式为2NH3-6e-=N2+6H+
D.当有4.48LNO2被处理时,转移电子数为0.8NA
【答案】B
【解析】
由反应6NO2+8NH3=7N2+12H2O可知,反应中NO2为氧化剂,在B极得到电子,发生还原反应,NH3为还原剂,在A极失去电子,发生氧化反应,则A为负极,B为正极,据此解答。
A.B为正极,A为负极,电流由正极B经导线流向负极A,故A错误;
B.电极B为正极,发生还原反应,正极反应为6NO2+24e-+12H2O=3N2+24OH-,故B正确;
C.电解质溶液呈碱性,A为负极,电极反应式为2NH3-6e-+60H-=N2+3H2O,故C错误;
D.没有明确4.48 L NO2是否是在标准状况下,无法计算转移电子数,故D错误。答案选B。

练习册系列答案
 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案
相关题目