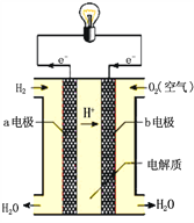
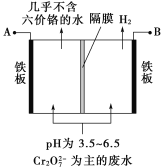
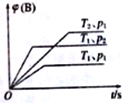
题目内容
【题目】现有一体积固定装有H2、CO、CO2混合气体的密闭容器,向其中加入过量的Na2O2,并不断用电火花点燃使其充分反应,反应结束后恢复至起始温度,测得容器内的压强(固体体积忽略不计)是起始状态的1/4。则原混合气体的平均相对分子质量可能是
A. 20g/mol B. 23g/mol C. 30g/mol D. 36g/mol
【答案】C
【解析】Na2O2与CO2反应:2Na2O2+2CO2=2Na2CO3+O2,CO与H2在氧气中完全燃烧,生成CO2和H2O,生成的CO2和H2O再与Na2O2反应。由2CO+O2![]() 2CO2,相当于可得总反应为:Na2O2+CO=Na2CO3,相当于吸收CO;由2H2+O2
2CO2,相当于可得总反应为:Na2O2+CO=Na2CO3,相当于吸收CO;由2H2+O2![]() 2H2O,2Na2O2+2H2O=4NaOH+O2↑,可得总反应为:Na2O2+H2=2NaOH,相当于吸收H2,故混合物气体反应,恢复到原温度,容器内的压强为原来的
2H2O,2Na2O2+2H2O=4NaOH+O2↑,可得总反应为:Na2O2+H2=2NaOH,相当于吸收H2,故混合物气体反应,恢复到原温度,容器内的压强为原来的![]() ,剩余气体为O2,不可能为H2或CO。令原混合物的物质的量为4mol,则反应后氧气的物质的量为1mol,由方程式可知原混合物中二氧化碳为2mol,氢气与CO共4mol-2mol=2mol,若为H2和CO2的混合物,二者物质的量之比为1:1,混合气体的平均相对分子质量为
,剩余气体为O2,不可能为H2或CO。令原混合物的物质的量为4mol,则反应后氧气的物质的量为1mol,由方程式可知原混合物中二氧化碳为2mol,氢气与CO共4mol-2mol=2mol,若为H2和CO2的混合物,二者物质的量之比为1:1,混合气体的平均相对分子质量为![]() =23,若为CO和CO2的混合物,二者物质的量之比为1:1,混合气体的平均相对分子质量为
=23,若为CO和CO2的混合物,二者物质的量之比为1:1,混合气体的平均相对分子质量为![]() =36,则混合气体的平均相对分子质量介于23
=36,则混合气体的平均相对分子质量介于23![]() 36,答案选C。
36,答案选C。

【题目】下面是某个品牌的食用碘盐包装上的标签。下列关于此标签的说法中正确的是( )
配料 | 精盐、碘酸钾、抗结剂 |
碘含量 | 35±15 mg·kg-1 |
储存方法 | 密封、避光、防潮 |
食用方法 | 烹饪时,待食品熟后加入碘盐 |
A. 高温会导致碘的损失
B. 碘酸钾可氧化氯化钠
C. 可用淀粉检验碘盐中的碘酸钾
D. 该碘盐中碘酸钾的含量为20~50 mg·kg-1