��Ŀ����
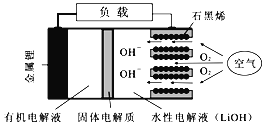
����Ŀ��ij�������õ�ⷨ����������ˮ�������������������������������ʢ�ź�����ˮ��ԭ��ʾ��ͼ���£�����˵������ȷ����
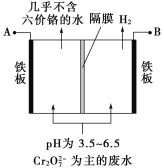
A��AΪ��Դ����
B����������Һ�з�����������ԭ��ӦΪ![]() +6Fe2++14H+===
+6Fe2++14H+===
2Cr3++6Fe3++7H2O
C��������������ҺpH����
D����������������ܽ⣬���ռ���H2 13.44 L(��״��)ʱ����0.1 mol ![]() ����ԭ
����ԭ
���𰸡�C
����������ͼ��֪B������H2��2H++2e��===H2����Ϊ������Ӧ����ü�����Һ��pH���ߣ����ӵ�Դ�ĸ�������A�����ӵ�Դ��������A����ȷ��C���������������Ӧ��Fe��2e��===Fe2+�����ɵ�Fe2+��![]() ��Ӧ��
��Ӧ��![]() +6Fe2++14H+===2Cr3++6Fe3++7H2O��B����ȷ������13.44 L H2��ת�Ƶ���1.2 mol�����ݵ����غ�����0.6 mol Fe2+���ɻ�ԭ0.1 mol
+6Fe2++14H+===2Cr3++6Fe3++7H2O��B����ȷ������13.44 L H2��ת�Ƶ���1.2 mol�����ݵ����غ�����0.6 mol Fe2+���ɻ�ԭ0.1 mol ![]() ��D��ȷ��
��D��ȷ��

��ϰ��ϵ�д�
 �������Ӧ���⼯ѵϵ�д�
�������Ӧ���⼯ѵϵ�д�
�����Ŀ