题目内容
【题目】含钴废催化剂(主要成分为Co、Fe、SiO2)为原料,制取氧化钴的流程如图1: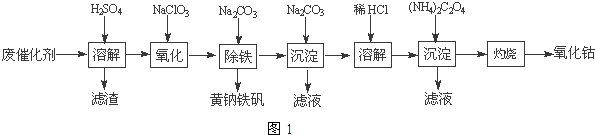
(1)溶解:溶解后过滤,将滤渣洗涤2~3次,洗液与滤液合并,其目的是;所得滤渣的主要成分是(写化学式).
(2)氧化:加热搅拌条件下加入NaClO3 , 将Fe2+氧化成Fe3+ , 其离子方程式;
已知:铁氰化钾化学式为K3[Fe(CN)6];亚铁氰化钾化学式为K4[Fe(CN)6]3H2O.
3Fe2++2[Fe(CN)6]3﹣═Fe3[Fe(CN)6]2↓(蓝色沉淀)
4Fe3++3[Fe(CN)6]4﹣═Fe4[Fe(CN)6]3↓(蓝色沉淀)
确定Fe2+是否氧化完全的方法是 . (可供选择的试剂:铁氰化钾溶液、亚铁氰化钾溶液、铁粉、KSCN溶液)
(3)除铁:加入适量的Na2CO3调节酸度,生成黄钠铁矾[Na2Fe6(SO4)4(OH)12]沉淀,写出该反应的化学方程式 .
(4)沉淀:生成沉淀碱式碳酸钴[(CoCO3)23Co(OH)2],沉淀需洗涤,洗涤的操作是 .
(5)溶解:CoCl2的溶解度曲线如图2所示.向碱式碳酸钴中加入足量稀盐酸,边加热边搅拌至完全溶解后,需趁热过滤,其原因是 . 
(6)灼烧:准确称取所得CoC2O4 1.470g,在空气中充分灼烧得0.830g氧化钴,写出氧化钴的化学式 .
【答案】
(1)提高钴等元素的利用率,SiO2
(2)6Fe2++6H++ClO3﹣ ![]() 6Fe3++Cl﹣+3H2O,取氧化后的溶液少许于试管中,滴加几滴铁氰化钾溶液,若无蓝色沉淀生成,则Fe2+已全部被氧化
6Fe3++Cl﹣+3H2O,取氧化后的溶液少许于试管中,滴加几滴铁氰化钾溶液,若无蓝色沉淀生成,则Fe2+已全部被氧化
(3)3Fe2(SO4)3+6H2O+6Na2CO3=Na2Fe6(SO4)4(OH)12↓+5Na2SO4+6CO2↑
(4)向漏斗中加入蒸馏水至浸没沉淀,静置使滤液流出.重复操作2~3次
(5)防止因温度降低,CoCl2晶体析出
(6)Co2O3
【解析】解:钴废催化剂加入稀硫酸,发生Co+H2SO4=CoSO4+H2↑,Fe+H2SO4=FeSO4+H2↑,过滤滤渣是不溶的二氧化硅,而滤液是硫酸钴、硫酸亚铁与过量的硫酸的混合溶液,向滤液中加氯酸钠将亚铁离子氧化成铁离子,然后加入碳酸钠得到黄钠铁矾[Na2Fe6(SO4)4(OH)12]沉淀,继续向滤液中加入碳酸钠,得到碱式碳酸钴[(CoCO3)23Co(OH)2],然后用盐酸溶解碱式碳酸钴[(CoCO3)23Co(OH)2],再向所到溶液中加入草酸铵,得到溶解度极小的草酸钴,最后燃烧生成氧化钴,(1)洗液与滤液合并,可提高洗涤和滤液中钴的利用率;所得滤渣为二氧化硅,化学式为:SiO2,
所以答案是:提高钴等元素的利用率;SiO2;(2)亚铁离子被氯酸根离子氧化成铁离子,1mol的亚铁离子失去1mol的电子,而1mol的氯酸根离子得到6mol的电子,根据电子得失守恒,可知离子方程式为:6Fe2++6H++ClO3﹣ ![]() 6Fe3++Cl﹣+3H2O,取氧化后的溶液少许于试管中,滴加几滴铁氰化钾溶液,若无蓝色沉淀生成,则Fe2+已全部被氧化,
6Fe3++Cl﹣+3H2O,取氧化后的溶液少许于试管中,滴加几滴铁氰化钾溶液,若无蓝色沉淀生成,则Fe2+已全部被氧化,
所以答案是:6Fe2++6H++ClO3﹣ ![]() 6Fe3++Cl﹣+3H2O;取氧化后的溶液少许于试管中,滴加几滴铁氰化钾溶液,若无蓝色沉淀生成,则Fe2+已全部被氧化;(3)生成硫酸铁与碳酸钠发生双水解得到黄钠铁矾,化学反应方程式为:3Fe2(SO4)3+6H2O+6 Na2CO3=Na2Fe6(SO4)4(OH)12↓+5 Na2SO4+6CO2↑,
6Fe3++Cl﹣+3H2O;取氧化后的溶液少许于试管中,滴加几滴铁氰化钾溶液,若无蓝色沉淀生成,则Fe2+已全部被氧化;(3)生成硫酸铁与碳酸钠发生双水解得到黄钠铁矾,化学反应方程式为:3Fe2(SO4)3+6H2O+6 Na2CO3=Na2Fe6(SO4)4(OH)12↓+5 Na2SO4+6CO2↑,
所以答案是:3Fe2(SO4)3+6H2O+6 Na2CO3=Na2Fe6(SO4)4(OH)12↓+5 Na2SO4+6CO2↑;(4)沉淀洗涤的方法是:向漏斗中加入蒸馏水至浸没沉淀,静置使滤液流出.重复操作2~3次,
所以答案是:向漏斗中加入蒸馏水至浸没沉淀,静置使滤液流出.重复操作2~3次;(5)CoCl2的溶解度曲线可知,随温度的升高,CoCl2的溶解度增大,所以趁热过滤,防止温度降低氯化钴析出,
所以答案是:防止因温度降低,CoCl2晶体析出;(6)CoC2O4的质量为1.470g,其我知道可为0.01mol,Co元素质量为0.59g,钴氧化物质量为0.83g,氧化物中氧元素质量为:0.83g﹣0.59g=0.24g,则氧化物中Co原子与O原子物质的量之比为0.01mol: ![]() ≈2:3,故Co氧化物为Co2O3,
≈2:3,故Co氧化物为Co2O3,
所以答案是:Co2O3.

【题目】下列关于纯净物、混合物、电解质和非电解质的正确组合是
纯净物 | 混合物 | 电解质 | 非电解质 | |
A | 盐酸 | 天然气 | 硫酸 | 干冰 |
B | 氢氧化钡 | 蔗糖溶液 | 碱石灰 | 三氧化硫 |
C | 胆矾 | 石灰水 | 苛性钾 | 氨气 |
D | 硫酸 | 铝合金 | 氯化钠 | 氢气 |
A. A B. B C. C D. D