题目内容
【题目】氯氧化铋在汽车装饰,电子设备等生活方面有广泛的应用。利用铜转炉烟尘(主要为含铋的化合物,另外还含Cu、Pb、Bi的硫酸盐及CuS、Fe2O3)可生产氯氧化铋,其工艺流程如下:

(1)提高“酸浸”反应速率的措施有适当增加硫酸的浓度和_____________。
(2) “浸渣1”中除铋的化合物外,还有的物质是_______________(填化学式)
(3) “浸液1”中加入过量锌粉,作用是____________________;反应完毕后,过滤,从滤液中得到ZnSO4·7H2O晶体的操作有________、________、过滤、洗涤、干燥。
(4)“浸铜”时,有单质硫生成,写出生成硫的离子方程式________________________
(5)“浸铋”时,在室温和液固比(盐酸、NaCl溶液组成的混合溶液的质量与“浸渣2”的质量的比值)固定的条件下,c(HCl)=1 mol·L-1时,铋的浸出率和Cl-浓度的关系如下图所示,其中NaCl的作用是_________,若升高温度,铋的浸出率反而下降,其可能的原因是__________________________________。

(6)“沉铋”时需要控制溶液的pH=3.0,此时BiCl3发生反应的化学方程式为___________
【答案】适当升高温度(或其他合理答案) CuS、PbSO4 确保Fe、Cu元素被完全除尽 加热浓缩 冷却结晶 CuS+4H++ MnO2 = Mn2++ Cu2++S↓+2H2O 提供较高浓度的Cl- 盐酸中HCl的挥发 BiCl3+ Na2CO3= BiOCl ↓+ 2NaCl+ CO2↑
【解析】
(1)提高“酸浸”反应速率的措施有适当增加硫酸的浓度和适当升高温度、搅拌等。
(2) PbSO4为白色沉淀,不与硫酸反应,CuS为黑色不溶于稀硫酸的固体;据以上分析解答。
(3) “浸液1”中含有锌离子、铁离子、铜离子,加入过量锌粉,锌能够与铁离子、铜离子反应生成铁和铜,据此进行分析;
(4) MnO2在酸性环境下具有氧化性,能够把硫离子氧化为单质硫,本身被还原为Mn2+,据此写出该反应方程式;
(5)根据图像变化规律可知,溶液中氯离子浓度增大,铋的浸出率就升高,反之,铋的浸出率下降;据此进行分析;
(6)BiCl3和Na2CO3反应生成BiOCl 沉淀和二氧化碳气体,据此写出反应的化学方程式。
(1)提高“酸浸”反应速率的措施有适当增加硫酸的浓度和适当升高温度(或其他合理答案);
综上所述,本题答案是:适当升高温度(或其他合理答案) 。
(2) PbSO4不溶于硫酸的固体,CuS不溶于稀硫酸的固体;因此从流程可以看出,样品经过酸浸后,“浸渣1”中除铋的化合物外,还有的物质是CuS、PbSO4;
综上所述,本题答案是:CuS、PbSO4;
(3) “浸液1”中含有锌离子、铁离子、铜离子,加入过量锌粉,锌能够与铁离子、铜离子反应生成铁和铜,确保Fe、Cu元素被完全除尽;反应完毕后,过滤,从滤液中得到ZnSO4·7H2O晶体的操作有加热浓缩、冷却结晶、过滤、洗涤、干燥。
综上所述,本题答案是:确保Fe、Cu元素被完全除尽;加热浓缩、冷却结晶;
(4) MnO2在酸性环境下具有氧化性,能够把硫离子氧化为单质硫,本身被还原为Mn2+,离子方程式为:CuS+4H++ MnO2 = Mn2++ Cu2++S↓+2H2O;
综上所述,本题答案是:CuS+4H++ MnO2 = Mn2++ Cu2++S↓+2H2O。
(5)根据图像变化规律可知,溶液中氯离子浓度增大,铋的浸出率就升高,因此NaCl的作用是提供较高浓度的Cl-,有利于铋的浸出;若升高温度,盐酸中HCl的挥发,反应物浓度降低,铋的浸出率反而下降;
综上所述,本题答案是:提供较高浓度的Cl-,盐酸中HCl的挥发。
(6) “沉铋”时需要控制溶液的pH=3.0,溶液呈酸性,BiCl3和Na2CO3反应生成BiOCl 沉淀和二氧化碳气体,反应的化学方程式为:BiCl3+ Na2CO3= BiOCl ↓+ 2NaCl+ CO2↑;
综上所述,本题答案是:BiCl3+Na2CO3= BiOCl↓+ 2NaCl+CO2↑。

 阅读快车系列答案
阅读快车系列答案【题目】工业上可用黄铜矿(CuFeS2)冶炼铜,同时还可得到多种物质。工业冶炼铜的化学方程式是:8CuFeS2+21O2![]() 8Cu+4FeO+2Fe2O3+16SO2
8Cu+4FeO+2Fe2O3+16SO2
(1)CuFeS2中Fe的化合价为+2,反应中被还原的元素是氧元素和____________。
(2)用少量黄铜矿冶炼铜产生的炉渣(主要含Fe2O3、FeO、SiO2、Al2O3)模拟制铁红(Fe2O3),进行如下实验。
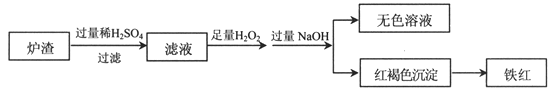
①滤液中的阳离子有Fe3+、Fe2+、H+、_____________。
②为确认滤液中含Fe2+,下列实验方案和预期现象正确的是____(填序号)。
实验方案 | 预期现象 | |
a | 加NaOH溶液 | 产生白色沉淀,变灰绿再变红褐 |
b | 先加KSCN溶液,再加氯水 | 先无明显现象,后变红 |
c | 加酸性KMnO4溶液 | 紫色褪去 |
d | 先加氯水,再加KSCN溶液 | 溶液先变黄,再变红 |
③滤液在酸性条件下,与H2O2反应的离子方程式是_________________________。
(3)m克铝热剂(氧化铁与铝)恰好完全反应,则该反应中氧化产物与还原产物的质量比是________________________。
【题目】已知化学反应①:Fe(s)+CO2(g)![]() FeO(s)+CO(g),其化学平衡常数为K1;化学反应②:Fe(s)+H2O(g)
FeO(s)+CO(g),其化学平衡常数为K1;化学反应②:Fe(s)+H2O(g)![]() FeO(s)+H2(g),其化学平衡常数为K2,在温度973 K和1173 K的情况下,K1、K2的值分别如下:
FeO(s)+H2(g),其化学平衡常数为K2,在温度973 K和1173 K的情况下,K1、K2的值分别如下:
温度 | K1 | K2 |
973 K | 1.47 | 2.38 |
1 173 K | 2.15 | 1.67 |
(1)通过表格中的数值可以推断:反应①是_______(填“吸热”或“放热”)反应。
(2)现有反应③:CO2(g)+H2(g)![]() CO(g)+H2O(g),请你写出该反应的平衡常数K3的表达式:K3=______。
CO(g)+H2O(g),请你写出该反应的平衡常数K3的表达式:K3=______。
(3)根据反应①与②可推导出K1、K2与K3之间的关系式为__________,据此关系式及上表数据,能推断出反应③是________(填“吸热”或“放热”)反应。
(4)要使反应③在一定条件下建立的平衡向正反应方向移动,可采取的措施有______ 、_____ (填写字母序号)。
A.缩小反应容器的容积 B.扩大反应容器的容积
C.升高温度 D.使用合适的催化剂
E.设法减小平衡体系中的CO的浓度
(5)图甲、乙分别表示反应③在t1时刻达到平衡,在t2时刻因改变某个条件而发生变化的情况:

①图甲中t2时刻发生改变的条件是__________。
②图乙中t2时刻发生改变的条件是__________。