题目内容
某工厂以精辉铜矿(主要成份为Cu2S)为原料冶炼铜,在炼铜炉内发生如下反应(在高温条件下进行):2Cu2S+3O2→2Cu2O+2SO2 2Cu2O+Cu2S→6Cu+SO2(1)若生成38.4吨金属铜,需要含杂质20%的精辉铜矿多少吨?(设杂质不参加反应)
(2)若(1)中产生的二氧化硫用于生产硫酸,可生产98%的硫酸多少吨(二氧化硫转化成三氧化硫的转化率为92%,三氧化硫的吸收率为98%)?
(3)今将a mol Cu2S 与b mol 空气(氧气约占空气体积的20%)在密闭容器中高温下发生反应,请完成下列表格:
| 反应后固体 的成分 | Cu | Cu2S、Cu | Cu2O、Cu |
| b的取值范围 |
【答案】分析:根据反应的化学方程式或关系式,从元素守恒的角度分析并解答.
解答:解:(1)设需精辉铜矿的质量为x,根据元素守恒:
Cu2S--------2Cu
160t 128t
x?80% 38.4t
x=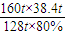 =60t
=60t
(2)设可生产98%的浓H2SO4的质量为y,根据元素守恒:
Cu2S→2Cu------------→H2SO4
160 128 98
38.4×92%×98% y×98%
y=27.05
(3)①反应后固体全部是Cu时,则:
Cu2S+O2=2Cu+SO2
a 0.2y
y=5a
②反应后固体为Cu2S、Cu时,氧气不足,则0<b<5a
③反应后固体为Cu2O、Cu,氧气过量,但并没有完全反应生成Cu2O,
根据2Cu2S+3O2→2Cu2O+2SO2
2 3
a 0.2y
y=7.5a
则:5a<b<7.5a
故答案为:
点评:本题考查化学方程式的相关计算,题目难度中等,注意从元素守恒的角度,利用关系式计算.
解答:解:(1)设需精辉铜矿的质量为x,根据元素守恒:
Cu2S--------2Cu
160t 128t
x?80% 38.4t
x=
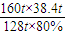 =60t
=60t (2)设可生产98%的浓H2SO4的质量为y,根据元素守恒:
Cu2S→2Cu------------→H2SO4
160 128 98
38.4×92%×98% y×98%
y=27.05
(3)①反应后固体全部是Cu时,则:
Cu2S+O2=2Cu+SO2
a 0.2y
y=5a
②反应后固体为Cu2S、Cu时,氧气不足,则0<b<5a
③反应后固体为Cu2O、Cu,氧气过量,但并没有完全反应生成Cu2O,
根据2Cu2S+3O2→2Cu2O+2SO2
2 3
a 0.2y
y=7.5a
则:5a<b<7.5a
故答案为:
| 反应后固体的成分 | Cu | Cu2S、Cu | Cu2O、Cu |
| b的取值范围 | b=5a | 0<b<5a | 5a<b<7.5a |
点评:本题考查化学方程式的相关计算,题目难度中等,注意从元素守恒的角度,利用关系式计算.

练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目
某工厂以精辉铜矿(主要成份为Cu2S)为原料冶炼铜,在炼铜炉内发生如下反应(在高温条件下进行):
![]() 2 Cu2S + 3 O2 → 2 Cu2O + 2 SO2 2 Cu2O + Cu2S → 6 Cu + SO2
2 Cu2S + 3 O2 → 2 Cu2O + 2 SO2 2 Cu2O + Cu2S → 6 Cu + SO2
![]() (1)若生成38.4吨金属铜,需要含杂质20%的精辉铜矿多少吨?(设杂质不参加反应)
(1)若生成38.4吨金属铜,需要含杂质20%的精辉铜矿多少吨?(设杂质不参加反应)
![]()
![]()
![]()
![]() (2)若(1)中产生的二氧化硫用于生产硫酸,可生产98%的硫酸多少吨(二氧化硫转化成三氧化硫的转化率为92%,三氧化硫的吸收率为98%)?
(2)若(1)中产生的二氧化硫用于生产硫酸,可生产98%的硫酸多少吨(二氧化硫转化成三氧化硫的转化率为92%,三氧化硫的吸收率为98%)?
![]()
![]()
![]()
![]()
![]()
![]()
![]() (3)今将a mol Cu2S 与b mol 空气(氧气约占空气体积的20%)在密闭容器中高温下发生反应,请完成下列表格:
(3)今将a mol Cu2S 与b mol 空气(氧气约占空气体积的20%)在密闭容器中高温下发生反应,请完成下列表格:
反应后固体
| Cu | Cu2S 、Cu | Cu2O、 Cu |
b的取值范围 |
|
|
|