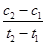题目内容
可逆反应A(?)+aB(g)  C(g)+2D(g)(a为正整数)。反应过程中,当其他条件不变时,C的百分含量(C%)与温度(T)和压强(p)的关系如图所示。下列说法不正确的是
C(g)+2D(g)(a为正整数)。反应过程中,当其他条件不变时,C的百分含量(C%)与温度(T)和压强(p)的关系如图所示。下列说法不正确的是

 C(g)+2D(g)(a为正整数)。反应过程中,当其他条件不变时,C的百分含量(C%)与温度(T)和压强(p)的关系如图所示。下列说法不正确的是
C(g)+2D(g)(a为正整数)。反应过程中,当其他条件不变时,C的百分含量(C%)与温度(T)和压强(p)的关系如图所示。下列说法不正确的是
| A.若a=2,则A为液态或固体 |
| B.该反应的正反应为放热反应 |
| C.T2>T1,p2>p1 |
| D.其他条件不变,增加B的物质的量,平衡正向移动,平衡常数K增大 |
D
试题分析:根据图1可知, 温度为T2的曲线首先达到平衡状态,这说明反应速率快,因此温度是T2大于T1。但温度越高,C的百分含量越低,这说明升高温度平衡向逆反应方向进行,因此正方应是放热反应。根据图2可知,压强为P2的首先达到平衡状态,这说明反应速率快,因此压强是P2大于P1。都能压强越大,C的百分含量越小,这说明增大压强平衡向逆反应方向移动,因此正方应是体积增大的可逆反应,所以如果a=2,则A一定为液态或固体,因此选项A、B、C都是正确的。平衡常数只与温度有关系,所以增加B的量,平衡常数是不变的,D不正确,答案选D。

练习册系列答案
 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案
相关题目
 2CO △H 1>0,反应速率v1 ,N2+3H2
2CO △H 1>0,反应速率v1 ,N2+3H2 2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此可推断
2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此可推断
 2Z(g)减小压强时,对反应的影响是( )
2Z(g)减小压强时,对反应的影响是( ) 2NH3(g)合成氨,下列叙述正确的是
2NH3(g)合成氨,下列叙述正确的是