题目内容
9.如表为元素周期表的一部分,请回答有关问题:| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 4 | ⑨ | ⑩ |
(2)表中能形成两性氧化物的元素是Al(填写元素符号),请写出该元素的氢氧化物与⑨的最高价氧化物对应水化物反应的化学方程式:Al(OH)3+KOH=KAlO2+2H2O
(3)元素⑥氢化物的化学式为H2S,其稳定性比H2O弱(填“强”或“弱”).
分析 由元素在周期表中位置,可知①为N、②为F、③为Mg、④为Al、⑤为Si、⑥为S、⑦为Cl、⑧为Ar、⑨为K,⑩为Br.
(1)同周期自左而右金属性减弱,同主族自上而下金属性增强;
(2)氧化铝是两性氧化物;氢氧化铝与氢氧化钾反应生成偏铝酸钾与水;
(3)元素⑥的氢化物为硫化氢;元素非金属性越强,对应氢化物越稳定.
解答 解:由元素在周期表中位置,可知①为N、②为F、③为Mg、④为Al、⑤为Si、⑥为S、⑦为Cl、⑧为Ar、⑨为K,⑩为Br.
(1)元素⑤的名称是硅;同周期自左而右金属性减弱,同主族自上而下金属性增强,上述元素中K的金属性最强,故答案为:硅;K;
(2)Al元素氧化物--氧化铝是两性氧化物;氢氧化铝与氢氧化钾反应生成偏铝酸钾与水,反应方程式为:Al(OH)3+KOH=KAlO2+2H2O,故答案为:Al;Al(OH)3+KOH=KAlO2+2H2O;
(3)元素⑥的氢化物为H2S,非金属性S<O,元素非金属性越强,对应氢化物越稳定,故氢化物稳定性:H2S<H2O,故答案为:H2S;弱.
点评 本题考查元素周期表与元素周期律,需要学生熟练掌握元素周期表,侧重对基础知识的巩固.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
12.如图表示水中c(H+)和c(OH-)的关系,下列判断错误的是( )


| A. | 两条曲线间任意点均有c(H+)×c(OH-)=KW | |
| B. | XZ线上任意点均有pH=7 | |
| C. | 图中T1<T2 | |
| D. | M区域内任意点均有c(H+)<c(OH-) |
20.下列表达正确的是( )
| A. | HClO的电子式为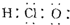 | |
| B. | H2S的电子式可表示为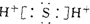 | |
| C. | 用电子式表示Na2O的形成过程为2Nax+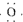 →2Na+ →2Na+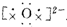 | |
| D. | MgCl2的电子式为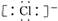 Mg2+ Mg2+ |
17.将下列各组物质按单质、酸、碱、盐分类顺序排列,其中正确的是( )
| A. | 水银、硫酸、烧碱、硫酸氢钠 | B. | 氯水、盐酸、火碱、硫酸钡 | ||
| C. | 臭氧、硝酸、纯碱、胆矾 | D. | 铜、醋酸、石灰石、氯化铜 |
4.X、Y、Z是周期表中相邻的三种短周期元素,X和Y同周期,Y和Z同主族,三种元素原子的最外层电子数之和为17,核内质子数之和为31,则X、Y、Z是( )
| A. | Mg Al Si | B. | Li Be Mg | C. | N O S | D. | P S O |
19.下列反应中符合下图图象的是( )


| A. | N2(g)+3H2(g)?2NH3(g)△H=-Q1 kJ•mol-1 (Q1>0) | |
| B. | 2SO3(g)?2SO2(g)+O2(g)△H=+Q2 kJ•mol-1 (Q2>0) | |
| C. | 4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H=-Q3 kJ•mol-1 (Q3>0) | |
| D. | H2(g)+CO(g)?C(s)+H2O(g)△H=+Q4 kJ•mol-1 (Q4>0) |
 、
、 (用元素符号表示)
(用元素符号表示) .
.